题目内容
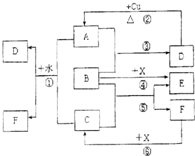
已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子.反应中部分生成物已略去.

试回答下列问题:
(1)根据图中信息,物质B、C、X氧化性从强到弱的顺序是
(2)B的电子式为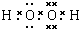
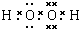 ,它属于
,它属于
(3)写出反应②的化学方程式:
(4)写出反应①、⑥的离子方程式:
①
⑥

试回答下列问题:
(1)根据图中信息,物质B、C、X氧化性从强到弱的顺序是
MnO2>Cl2>H2O2
MnO2>Cl2>H2O2
.(用化学式表示)(2)B的电子式为
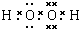
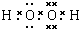
分子
分子
晶体.(3)写出反应②的化学方程式:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(4)写出反应①、⑥的离子方程式:
①
Cl2+SO2+2H2O═4H++SO22-+2Cl-
Cl2+SO2+2H2O═4H++SO22-+2Cl-
.⑥
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
分析:已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志判断为H2SO4,A为SO2,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,判断反应是制备氯气的反应原理,X为MnO2,C为Cl2,F为HCl;B分子中有18个电子,和二氧化硫反应生成硫酸,说明B是氧化剂;推断B为H2O2,和MnO2反应,过氧化氢做还原剂生成氧气,E为O2;依据推断回答问题.
解答:解:已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志判断为H2SO4,A为SO2,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,判断反应是制备氯气的反应原理,X为MnO2,C为Cl2,F为HCl;B分子中有18个电子,和二氧化硫反应生成硫酸,说明B是氧化剂;推断B为H2O2,和MnO2反应,过氧化氢做还原剂生成氧气,E为O2;
(1)据图中信息,物质B为H2O2、C为SO2、X为MnO2,氧化性从强到弱的顺序依据反应关系,H2O2+SO2=H2SO4;
H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑;MnO2+4HCl=MnCl2+Cl2↑+2H2O,发生的氧化还原反应中氧化剂氧化性大于氧化产物得到:MnO2>Cl2>H2O2,
故答案为:MnO2>Cl2>H2O2;
(2)B为H2O2是共价化合物,电子式为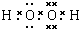 ,属于分子晶体,故答案为:
,属于分子晶体,故答案为: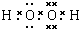 ;分子;
;分子;
(3)反应②的化学方程式是铜和浓硫酸反应生成硫酸铜、二氧化硫和水的反应,反应化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(4)反应①是氯气和二氧化硫在水溶液中发生的反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++SO22-+2Cl-;反应⑥是实验室制备氯气的反应,反应的离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:Cl2+SO2+2H2O═4H++SO22-+2Cl-;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O.
(1)据图中信息,物质B为H2O2、C为SO2、X为MnO2,氧化性从强到弱的顺序依据反应关系,H2O2+SO2=H2SO4;
H2O2+MnO2+H2SO4=MnSO4+2H2O+O2↑;MnO2+4HCl=MnCl2+Cl2↑+2H2O,发生的氧化还原反应中氧化剂氧化性大于氧化产物得到:MnO2>Cl2>H2O2,
故答案为:MnO2>Cl2>H2O2;
(2)B为H2O2是共价化合物,电子式为
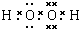 ,属于分子晶体,故答案为:
,属于分子晶体,故答案为: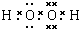 ;分子;
;分子;(3)反应②的化学方程式是铜和浓硫酸反应生成硫酸铜、二氧化硫和水的反应,反应化学方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(4)反应①是氯气和二氧化硫在水溶液中发生的反应生成硫酸和盐酸,反应的离子方程式为:Cl2+SO2+2H2O═4H++SO22-+2Cl-;反应⑥是实验室制备氯气的反应,反应的离子方程式为:MnO2+4H++2Cl-
| ||
故答案为:Cl2+SO2+2H2O═4H++SO22-+2Cl-;MnO2+4H++2Cl-
| ||
点评:本题考查了物质转化关系的分析判断,物质性质的应用,反应特征和反应现象的推断是解题关键,需要熟练掌握物质性质,反应转化关系,题目难度较大.

练习册系列答案
相关题目
 已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:
已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题: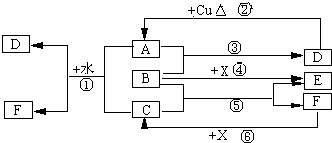
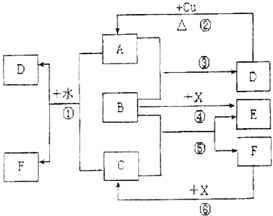 已知A~F是中学化学常见的物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:
已知A~F是中学化学常见的物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题: