题目内容
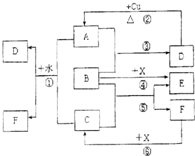 已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:
已知A~F是中学化学中常见物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是
X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4)
X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4)
.(2)X与铝高温下反应的方程式为
3MnO2+4Al
3Mn+2Al2O3
| ||
3MnO2+4Al
3Mn+2Al2O3
.
| ||
(3)写出反应②的化学方程式
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
(4)写出反应①、⑥的离子方程式:
①
Cl2+SO2+2H2O=4H++SO42-+2Cl-
Cl2+SO2+2H2O=4H++SO42-+2Cl-
.⑥
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
分析:X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E,应为H2O2在MnO2催化条件下生成的反应,则X为MnO2,B为H2O2,E为O2,F的溶液与X共热通常用于实验室制备单质C,为MnO2和浓盐酸反应制备Cl2的反应,则F为HCl,C为Cl2,D是一种不挥发性酸,其浓溶液有强氧化性,应为H2SO4,可由A可H2O2反应生成,则A为SO2,结合物质的性质解答该题.
解答:解:X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E,应为H2O2在MnO2催化条件下生成的反应,则X为MnO2,B为H2O2,E为O2,F的溶液与X共热通常用于实验室制备单质C,为MnO2和浓盐酸反应制备Cl2的反应,则F为HCl,C为Cl2,D是一种不挥发性酸,其浓溶液有强氧化性,应为H2SO4,可由A可H2O2反应生成,则A为SO2,
(1)根据氧化剂氧化性大于氧化产物的氧化性可判断:X生成C,则氧化性X>C,在B和C的反应中C表现为氧化性,B表现为还原性,则氧化性C>B,B和A反应生成D,则氧化性B>D,则有氧化性X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4),
故答案为:X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4);
(2)Al比Mn活泼,可发生铝热反应制取Mn,反应的方程式为3MnO2+4Al
3Mn+2Al2O3,
故答案为:3MnO2+4Al
3Mn+2Al2O3;
(3)反应②为铜和浓硫酸的反应,方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(4)反应①为Cl2和SO2发生氧化还原反应,反应的离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-,
反应⑥为MnO2和浓盐酸发生反应制备Cl2的反应,反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,
故答案为:Cl2+SO2+2H2O=4H++SO42-+2Cl-;MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O.
(1)根据氧化剂氧化性大于氧化产物的氧化性可判断:X生成C,则氧化性X>C,在B和C的反应中C表现为氧化性,B表现为还原性,则氧化性C>B,B和A反应生成D,则氧化性B>D,则有氧化性X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4),
故答案为:X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4);
(2)Al比Mn活泼,可发生铝热反应制取Mn,反应的方程式为3MnO2+4Al
| ||
故答案为:3MnO2+4Al
| ||
(3)反应②为铜和浓硫酸的反应,方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(4)反应①为Cl2和SO2发生氧化还原反应,反应的离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-,
反应⑥为MnO2和浓盐酸发生反应制备Cl2的反应,反应的离子方程式为MnO2+4H++2Cl-
| ||
故答案为:Cl2+SO2+2H2O=4H++SO42-+2Cl-;MnO2+4H++2Cl-
| ||
点评:本题考查无机物的推断,题目难度不大,本题注意把握物质的分子构成特点以及典型的物理性质,常作为推断题的突破口,答题时注意体会.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目

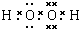
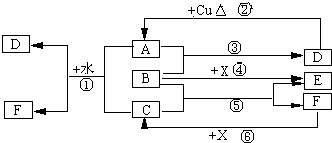
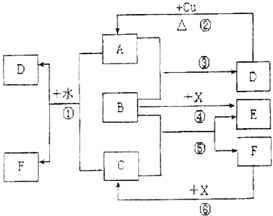 已知A~F是中学化学常见的物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题:
已知A~F是中学化学常见的物质,其中A、C、E为气体,B、D为液体,D是一种不挥发性酸,其浓溶液有强氧化性,F的溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子,实验室常用B和X制备单质E.反应中部分生成物已略去.试回答下列问题: