题目内容
【题目】N、Cu及其相关化合物用途非常广泛。回答下列问题:
(1)基态铜原子的价电子排布式为__________________。
(2)NH3分子的立体构型为_________,中心原子的杂化类型是_________。
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能最大的是_________,电负性最小的是_________。(填元素符号)
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,则可判定Cu2O为_________(填“离子晶体”或“分子晶体”,下同),CuCl为_________。
(5)氮与铜形成的一种化合物的晶胞结构如图所示。

与每个Cu原子紧邻的Cu原子有_________个,阿伏加德罗常数的数值为NA,该晶体的密度为_________(列出计算式)g·cm-3。
【答案】3d104s1 三角锥形 sp3 N P 离子晶体 分子晶体 8 ![]()
【解析】
(1)铜是29号元素,基态铜原子的价电子排布式为3d104s1。
(2)NH3中N价层电子对数=3+![]() =4,孤对电子数为1,N原子的杂化类型是sp3。
=4,孤对电子数为1,N原子的杂化类型是sp3。
(3)N原子2p轨道处于半充满状态,能量低,故第一电离能最大,同周期随着原子序数增大电负性增大,同主族自上而下电负性减小。
(4)根据熔点大小可判断。
(5)根据均摊法计算。
(1)铜是29号元素,基态铜原子的价电子排布式为3d104s1。故答案为:3d104s1;
(2)NH3中N价层电子对数=3+![]() =4,孤对电子数为1,中心原子的杂化类型是sp3,NH3分子的立体构型为三角锥形。故答案为:三角锥形;sp3;
=4,孤对电子数为1,中心原子的杂化类型是sp3,NH3分子的立体构型为三角锥形。故答案为:三角锥形;sp3;
(3)N、S、P是组成蛋白质的常见元素。三种元素中第一电离能N>P>S,原因是N原子2p轨道处于半充满状态,能量低,三种元素中第一电离能最大的是N,同周期随着原子序数增大电负性增大,同主族自上而下电负性减小,电负性N>S>P,电负性最小的是P。(填元素符号),故答案为:N;P;
(4)已知:Cu2O熔点为1235℃,CuCl熔点为426℃,根据熔点大小可判断Cu2O为离子晶体,CuCl为分子晶体。故答案为:离子晶体;分子晶体;
(5)Cu原子都在棱上,与每个Cu原子紧邻的Cu原子有8个,在立方晶胞中,顶点粒子占![]() ,棱上粒子占
,棱上粒子占![]() ,因此一个晶胞中,Cu的数目为3,N的数目为1,该晶体的化学式为Cu3N,Cu3N的摩尔质量为206g·mol-1,1nm=10-9m=10-7cm,密度=
,因此一个晶胞中,Cu的数目为3,N的数目为1,该晶体的化学式为Cu3N,Cu3N的摩尔质量为206g·mol-1,1nm=10-9m=10-7cm,密度=![]() =
=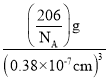 ,该晶体的密度为
,该晶体的密度为![]() g·cm-3。故答案为:8;
g·cm-3。故答案为:8;![]() 。
。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等