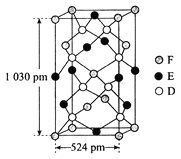
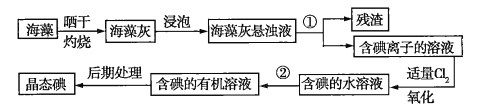
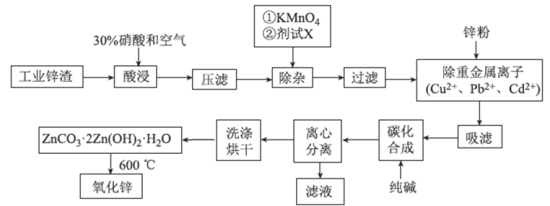
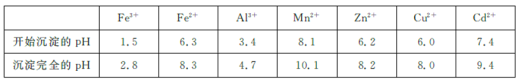
题目内容
【题目】已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g.(铁的相对原子质量:56)请回答下列问题:
2PbSO4+2H2O。现用如图装置进行电解实验,测得当铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g.(铁的相对原子质量:56)请回答下列问题:
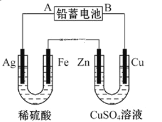
①A是铅蓄电池的__________极,
②Ag电极的电极反应式是__________,该电极的电极产物有__________g.
③Cu电极的电极反应式是__________,CuSO4溶液的浓度__________(填“减小”“增大”或“不变”)。
④如图表示电解进行过程中某个物理量x随时间t的变化曲线,其中曲线Ⅰ表示左侧U形管中的变化,曲线Ⅱ表示右侧U形管中的变化,则x表示(_______)
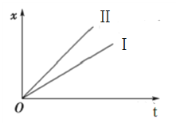
A.U形管中产生的气体的体积 B.U形管中阳极质量的减少量C.U形管中阴极质量的增加量
【答案】负 2H++2e-=H2↑ 0.4 Cu-2e-=Cu2+ 不变 B
【解析】
已知铅蓄电池中转移0.4mol电子时,铁电极的质量减少11.2g,则左边电解池中Fe为阳极,Ag为阴极,则铅蓄电池A为负极,B为正极,据此解答。
①分析可知,A是铅蓄电池的负极,故答案为:负;
②Ag电极为电解池的阴极,氢离子在Ag电极得电子生成氢气,电极反应式为2H++2e-=H2↑,转移0.4mol电子时,生成0.2mol氢气,即0.2mol×2g/mol=0.4g,故答案为:2H++2e-=H2↑;0.4;
③Cu与铅蓄电池的正极相连,为阳极,铜失电子生成铜离子,电极反应式为Cu-2e-=Cu2+,Zn为阴极,溶液中的铜离子在阴极得电子生成铜,则溶液中的铜离子浓度不变,SO42-没有参与反应,浓度也不变,所以,CuSO4的浓度不变,故答案为:Cu-2e-=Cu2+;不变;
④A.右侧U形管中无气体生成,与图象不符,A错误;
B.左侧U形管中阳极为Fe,发生反应为:Fe-2e-=Fe2+,右侧U形管中阳极为Cu,发生反应为:Cu-2e-=Cu2+,随反应时间的增大,质量减少量增大,且根据![]() 可知,相同时间内,Fe减少的质量小于Cu减小的质量,与图象相符,B正确;
可知,相同时间内,Fe减少的质量小于Cu减小的质量,与图象相符,B正确;
C.稀硫酸电解池中阴极产生氢气,阴极的质量不变,与图象不符,C错误;
故答案为:B。