题目内容
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:CO2+H2O?H2CO3
H2CO3?

 ?
?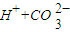
如图为H2CO3、
 、
、 在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
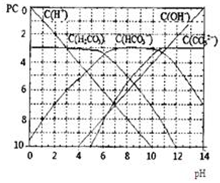
在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:(1)在pH=9时,H2CO3溶液中浓度最大的含碳元素离子为______.
(2)pH<4时,溶液中H2CO3的pC值总是约等于3的原因是______.
(3)一定浓度的NaHCO3和NaCO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化都不大,请用离子方程式表示加入少量强碱后其pH变化不大的原因______.
(4)已知M2CO3为难溶物,则其KSP的表达式为______;现欲将某溶液中的M+以碳酸盐(KSP=1×10-12)的形式沉淀完全,则最后溶液中的
 的pC最大值为______(溶液中的离子浓度小于1×10-5mol/L时,沉定完全).
的pC最大值为______(溶液中的离子浓度小于1×10-5mol/L时,沉定完全).(5)若某溶液中含3mol Na2CO3,滴入一定量的稀盐酸,恰好使溶液中Cl-和
 的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于______mol.
的物质的量之比为2:1,则滴入的盐酸中HCl的物质的量等于______mol.
【答案】分析:由图象可知,横坐标为pH,纵坐标为pC,由图象的曲线可分析(1)、(2);
(3)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入碱时与碳酸氢根离子反应;
(4)M2CO3?2M++CO32-,Ksp为离子浓度幂之比,由溶液中的离子浓度小于1×10-5mol/L时,沉定完全来计算CO32-浓度;
(5)根据发生的反应Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+H2O+CO2↑,由恰好使溶液中Cl-和HCO3-的物质的量之比为2:1来分析.
解答:解:(1)由图象可知,横坐标为pH,纵坐标为pC,pH=9时,H2CO3溶液中浓度最大的含碳元素离子为HCO3-,
故答案为:HCO3-;
(2)由图象可知,横坐标为pH,纵坐标为pC,pH<4时,溶液中H2CO3的pC值总是约等于3是因c(H+)增大后,平衡向左移动放出CO2,碳酸浓度保持不变,
故答案为:c(H+)增大后,平衡向左移动放出CO2,碳酸浓度保持不变;
(3)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入碱时与碳酸氢根离子反应,该离子反应为HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
(4)因M2CO3?2M++CO32-,则Ksp=c2(M+)?c(CO32-),当M+以碳酸盐的形式沉淀完全,
则c(CO32-)=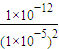 =10-2,所以pC最大值为-lg10-2=2,
=10-2,所以pC最大值为-lg10-2=2,
故答案为:Ksp=c2(M+)?c(CO32-);2;
(5)恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,由
Na2CO3+HCl═NaHCO3+NaCl、
3 3 3 3
NaHCO3+HCl═NaCl+H2O+CO2↑
1 1 1
Cl-和HCO3-的物质的量之比为(3+1):(3-1)=2:1,
即加入HCl4mol可满足题意,故答案为:4.
点评:本题考查弱电解质在水溶液中的电离及图象,学生能正确了利用图象来分析是解答本题的关键,并注意利用习题中的信息来解答,难度不大.
(3)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入碱时与碳酸氢根离子反应;
(4)M2CO3?2M++CO32-,Ksp为离子浓度幂之比,由溶液中的离子浓度小于1×10-5mol/L时,沉定完全来计算CO32-浓度;
(5)根据发生的反应Na2CO3+HCl═NaHCO3+NaCl、NaHCO3+HCl═NaCl+H2O+CO2↑,由恰好使溶液中Cl-和HCO3-的物质的量之比为2:1来分析.
解答:解:(1)由图象可知,横坐标为pH,纵坐标为pC,pH=9时,H2CO3溶液中浓度最大的含碳元素离子为HCO3-,
故答案为:HCO3-;
(2)由图象可知,横坐标为pH,纵坐标为pC,pH<4时,溶液中H2CO3的pC值总是约等于3是因c(H+)增大后,平衡向左移动放出CO2,碳酸浓度保持不变,
故答案为:c(H+)增大后,平衡向左移动放出CO2,碳酸浓度保持不变;
(3)“缓冲溶液”中加入少量的强酸或强碱,溶液的pH变化都不大,加入碱时与碳酸氢根离子反应,该离子反应为HCO3-+OH-=H2O+CO32-,故答案为:HCO3-+OH-=H2O+CO32-;
(4)因M2CO3?2M++CO32-,则Ksp=c2(M+)?c(CO32-),当M+以碳酸盐的形式沉淀完全,
则c(CO32-)=
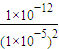 =10-2,所以pC最大值为-lg10-2=2,
=10-2,所以pC最大值为-lg10-2=2,故答案为:Ksp=c2(M+)?c(CO32-);2;
(5)恰好使溶液中Cl-和HCO3-的物质的量之比为2:1,由
Na2CO3+HCl═NaHCO3+NaCl、
3 3 3 3
NaHCO3+HCl═NaCl+H2O+CO2↑
1 1 1
Cl-和HCO3-的物质的量之比为(3+1):(3-1)=2:1,
即加入HCl4mol可满足题意,故答案为:4.
点评:本题考查弱电解质在水溶液中的电离及图象,学生能正确了利用图象来分析是解答本题的关键,并注意利用习题中的信息来解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol?L-1,则该溶液中溶质的pC=3.下列表达正确的是( )
| A、某温度下任何电解质的水溶液中,pC(H+)+pC(OH-)=14 | B、0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 | C、用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 | D、某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B-)=10 |
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡: 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题: