题目内容
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol?L-1,则该溶液中溶质的pC=3.下列表达正确的是( )
| A、某温度下任何电解质的水溶液中,pC(H+)+pC(OH-)=14 | B、0.01mol/L的CaCl2溶液中逐渐滴加纯碱溶液,滴加过程中pC(Ca2+)逐渐减小 | C、用0.01mol/L的盐酸滴定某浓度的NaOH溶液,滴定过程中pC(H+)逐渐增大 | D、某温度下,AB难溶性离子化合物的Ksp=1.0×10-10,其饱和溶液中pC(A+)+pC(B-)=10 |
分析:A、Kw的大小受到温度的影响,pC(H+)+pC(OH-)=-lgKw;
B、pC(Ca2+)与C(Ca2+)成反比;
C、滴定过程中碱性减弱,C(H+)逐渐增大;
D、由Ksp表达式和pC定义即可计算出pC(A+)+pC(B-)的大小.
B、pC(Ca2+)与C(Ca2+)成反比;
C、滴定过程中碱性减弱,C(H+)逐渐增大;
D、由Ksp表达式和pC定义即可计算出pC(A+)+pC(B-)的大小.
解答:解:A、Kw的大小受到温度的影响,温度越高Kw越大,Kw=C(H+)?C(OH-),pC(H+)+pC(OH-)=-lgC(H+)?C(OH-)=-lgKw,只有在常温下kw=10-14,pC(H+)+pC(OH-)=14,故A错误;
B、滴加过程中碳酸根和钙离子反应生成碳酸钙沉淀,C(Ca2+)逐渐减小,pC(Ca2+)与C(Ca2+)成反比,所以pC(Ca2+)逐渐增大,故B错误;
C、用0.01mol/L的盐酸滴定某浓度的NaOH溶液过程中,氢离子与氢氧根反应生成水,碱性减弱,C(H+)逐渐增大,pC(H+)逐渐减小,故C错误;
D、因为Ksp=C(A+)?C(B-)=1.0×10-10,所以pC(A+)+pC(B-)=-lgC(A+)?C(B-)=-lgKsp=-lg(1.0×10-10)=10,故D正确;
故选:D.
B、滴加过程中碳酸根和钙离子反应生成碳酸钙沉淀,C(Ca2+)逐渐减小,pC(Ca2+)与C(Ca2+)成反比,所以pC(Ca2+)逐渐增大,故B错误;
C、用0.01mol/L的盐酸滴定某浓度的NaOH溶液过程中,氢离子与氢氧根反应生成水,碱性减弱,C(H+)逐渐增大,pC(H+)逐渐减小,故C错误;
D、因为Ksp=C(A+)?C(B-)=1.0×10-10,所以pC(A+)+pC(B-)=-lgC(A+)?C(B-)=-lgKsp=-lg(1.0×10-10)=10,故D正确;
故选:D.
点评:本题考查Kw、Ksp影响因素及计算、离子反应等知识,重在考查知识迁移能力,培养了学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡:
pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为1×10-3mol/L,则溶液中该溶质的pC=-lg10-3=3.已知H2CO3溶液中存在下列平衡: 此条件下,该反应达到化学平衡时,氮气的浓度为
此条件下,该反应达到化学平衡时,氮气的浓度为
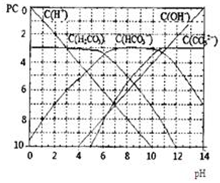 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题: