题目内容
实验室有一瓶Na2SO3固体,可能含有NaCl、Na2SO4、BaCl2、K2CO3、K2SO4中的一种或几种杂质,通过下列实验确定该样品的成分及Na2SO3的质量分数.
①取少量样品于试管中,加水振荡,未见沉淀生成;
②透过蓝色钴玻璃观察,焰色反应无紫色;
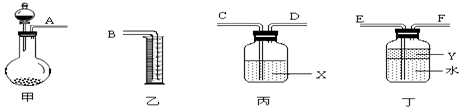
③用右图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)
请回答下列问题:
(1)按气流从左到右方向,正确的连接顺序为:A接 , 接 , 接B.
(2)利用所组装置,由分液漏斗向圆底烧瓶中滴加10mL水,将排入量筒中 mL液体.
(3)液体X是 ,其作用是 .
(4)Y的作用是防止产生的气体溶于水,下列所给试剂符合要求的是 .
A.苯B.四氯化碳C.酒精D.汽油
若称取样品3.00g,加入10.0mol/L的硫酸至过量(共5mL),产生无色气体,排入量筒中液体的体积为229mL(标准状况).
(5)对获得准确的气体体积无益的操作有 (填序号)
①检查装置的气密性;
②连通乙、丁的导管要预先注满水;
③读数时视线与量筒内凹液面最低点相平;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平;
⑤在甲装置胶塞上再连接一个导管,通入N2将系统中SO2全部排出.
(6)向逸出气体后的溶液中加入稍过量的BaCl2溶液,过滤、洗涤、干燥,得到白色沉淀13.98g.根据实验所得现象及数据,可知:样品中Na2SO3的质量分数是 ,含有的杂质是 .

①取少量样品于试管中,加水振荡,未见沉淀生成;
②透过蓝色钴玻璃观察,焰色反应无紫色;
③用右图所示仪器进行合理组装,测定产生气体的体积(SO2在硫酸中的溶解忽略不计)
请回答下列问题:
(1)按气流从左到右方向,正确的连接顺序为:A接
(2)利用所组装置,由分液漏斗向圆底烧瓶中滴加10mL水,将排入量筒中
(3)液体X是
(4)Y的作用是防止产生的气体溶于水,下列所给试剂符合要求的是
A.苯B.四氯化碳C.酒精D.汽油
若称取样品3.00g,加入10.0mol/L的硫酸至过量(共5mL),产生无色气体,排入量筒中液体的体积为229mL(标准状况).
(5)对获得准确的气体体积无益的操作有
①检查装置的气密性;
②连通乙、丁的导管要预先注满水;
③读数时视线与量筒内凹液面最低点相平;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平;
⑤在甲装置胶塞上再连接一个导管,通入N2将系统中SO2全部排出.
(6)向逸出气体后的溶液中加入稍过量的BaCl2溶液,过滤、洗涤、干燥,得到白色沉淀13.98g.根据实验所得现象及数据,可知:样品中Na2SO3的质量分数是
分析:①取少量样品于试管中,加水振荡,未见沉淀生成,说明不含BaCl2;
②透过蓝色钴玻璃观察,焰色反应无紫色,说明不含K2CO3、K2SO4;
(1)根据发生装置、干燥装置、排水装置和收集装置排序;
(2)加入水的体积等于排除气体的体积,等于排入量筒中液体的体积;
(3)X为浓硫酸干燥二氧化硫;
(4)Y小于水的密度且和水不互溶;
(5)①检查装置的气密性防止漏气;
②连通乙、丁的导管要预先注满水防止二氧化硫排出不净;
③读数时视线与量筒内凹液面最低点相平能得到准确气体体积;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平,防止产生压强差而使气体体积不准确;
⑤在甲装置胶塞上再连接一个导管,通入N2的氮气可能进入丁中导致气体体积不准确;
(6)根据原子守恒计算亚硫酸的质量,再结合质量分数公式计算亚硫酸钠的质量分数,根据生成的硫酸钡的物质的量和硫酸的物质的量判断是否含有硫酸钠,根据总质量确定是否含有氯化钠.
②透过蓝色钴玻璃观察,焰色反应无紫色,说明不含K2CO3、K2SO4;
(1)根据发生装置、干燥装置、排水装置和收集装置排序;
(2)加入水的体积等于排除气体的体积,等于排入量筒中液体的体积;
(3)X为浓硫酸干燥二氧化硫;
(4)Y小于水的密度且和水不互溶;
(5)①检查装置的气密性防止漏气;
②连通乙、丁的导管要预先注满水防止二氧化硫排出不净;
③读数时视线与量筒内凹液面最低点相平能得到准确气体体积;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平,防止产生压强差而使气体体积不准确;
⑤在甲装置胶塞上再连接一个导管,通入N2的氮气可能进入丁中导致气体体积不准确;
(6)根据原子守恒计算亚硫酸的质量,再结合质量分数公式计算亚硫酸钠的质量分数,根据生成的硫酸钡的物质的量和硫酸的物质的量判断是否含有硫酸钠,根据总质量确定是否含有氯化钠.
解答:解:①取少量样品于试管中,加水振荡,未见沉淀生成,说明不含BaCl2;
②透过蓝色钴玻璃观察,焰色反应无紫色,说明不含K2CO3、K2SO4;
(1)根据发生装置、干燥装置、排水装置和收集装置排序,注意干燥装置中导气管遵循“长进短出”,排水装置中遵循“短进长出”的原则,所以其排列顺序是:C、D、F、E,故答案为:C;D;F;E;
(2)加入水的体积等于排除气体的体积,等于排入量筒中液体的体积,所以为10mL,故答案为:10;
(3)X为浓硫酸,干燥二氧化硫,故答案为:浓硫酸;干燥SO2 ;
(4)根据图片知,Y小于水的密度且和水不互溶,苯和汽油的密度小于水且和水不互溶,四氯化碳的密度大于水,酒精和水互溶,故选A、D;
(5)①检查装置的气密性防止漏气而导致测量气体体积不准确,所以对获得准确的气体体积有益,故不选;
②连通乙、丁的导管要预先注满水防止二氧化硫排出不净,所以对获得准确的气体体积有益,故不选;
③读数时视线与量筒内凹液面最低点相平能得到准确气体体积,所以对获得准确的气体体积有益,故不选;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平,防止产生压强差而使气体体积不准确,所以对获得准确的气体体积有益,故不选;
⑤在甲装置胶塞上再连接一个导管,通入N2的氮气可能进入丁中导致气体体积不准确,故选;
故选⑤;
(6)根据题意知,二氧化硫的体积是229mL,根据硫原子守恒得亚硫酸钠的质量分数=
×100%=42%(或0.42);
13.98g硫酸钡中硫酸根离子的物质的量=
=0.06mol,硫酸中硫酸根离子的物质的量=10.0mol/L×0.005L=0.05mol<0.06mol,所以含有硫酸钠,且硫酸钠的质量=142g/mol×(0.06-0.05)mol=1.42g,
亚硫酸钠的质量=
×126g/mol=1.29g,
硫酸钠和亚硫酸钠的质量之和=1.42g+1.29g=2.71g<3.00g,所以含有氯化钠,
故答案为:42%;NaCl、Na2SO4.
②透过蓝色钴玻璃观察,焰色反应无紫色,说明不含K2CO3、K2SO4;
(1)根据发生装置、干燥装置、排水装置和收集装置排序,注意干燥装置中导气管遵循“长进短出”,排水装置中遵循“短进长出”的原则,所以其排列顺序是:C、D、F、E,故答案为:C;D;F;E;
(2)加入水的体积等于排除气体的体积,等于排入量筒中液体的体积,所以为10mL,故答案为:10;
(3)X为浓硫酸,干燥二氧化硫,故答案为:浓硫酸;干燥SO2 ;
(4)根据图片知,Y小于水的密度且和水不互溶,苯和汽油的密度小于水且和水不互溶,四氯化碳的密度大于水,酒精和水互溶,故选A、D;
(5)①检查装置的气密性防止漏气而导致测量气体体积不准确,所以对获得准确的气体体积有益,故不选;
②连通乙、丁的导管要预先注满水防止二氧化硫排出不净,所以对获得准确的气体体积有益,故不选;
③读数时视线与量筒内凹液面最低点相平能得到准确气体体积,所以对获得准确的气体体积有益,故不选;
④恢复到室温后再上下调整量筒位置,使乙、丁两液面相平,防止产生压强差而使气体体积不准确,所以对获得准确的气体体积有益,故不选;
⑤在甲装置胶塞上再连接一个导管,通入N2的氮气可能进入丁中导致气体体积不准确,故选;
故选⑤;
(6)根据题意知,二氧化硫的体积是229mL,根据硫原子守恒得亚硫酸钠的质量分数=
| ||
| 3.00g |
13.98g硫酸钡中硫酸根离子的物质的量=
| 13.98g |
| 233g/mol |
亚硫酸钠的质量=
| 0.229L |
| 22.4L/mol |
硫酸钠和亚硫酸钠的质量之和=1.42g+1.29g=2.71g<3.00g,所以含有氯化钠,
故答案为:42%;NaCl、Na2SO4.
点评:本题考查了探究物质的组成及含量的测定,难点是确定混合物的成分,注意硫酸钡沉淀中硫酸根离子不仅包含硫酸中硫酸根离子还包含混合物中硫酸根离子,为易错点.

练习册系列答案
相关题目
 实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )
实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( )| A、只用盐酸一种试剂就可以确定该固体M的具体成分 | B、往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3 | C、往溶液中加入稀硝酸酸化的BaCl2,若有白色沉淀,则固体M为Na2SO4 | D、用pH试纸检验,若pH=7,则固体M一定是Na2SO4 |
按要求填空。
Ⅰ:已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________
Ⅱ:
【小题1】硫酸铜晶体的溶解度虽大,但溶解过程较慢,实验室常用热水配制以加快溶解速率,但常常会产生浑浊,请用文字简要说明原因____________如何才能用热水配制出澄清的较浓的CuSO4溶液____________________;
【小题2】稀Na2S溶液有一种臭鸡蛋气味,加入AlCl3溶液后,臭鸡蛋气味加剧,用离子方程式表示气味加剧过程所发生的反应___________________________
III:依据氧化还原反应:MnO4-+5Fe2++8H+ = Mn2++5Fe3++4H2O,欲采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
①称量绿矾样品15.2g,配成100 mL待测溶液②取10.0ml待测液置于锥形瓶中,并加入一定量的硫酸③将0.1 mol?L-1的KMnO4溶液装入滴定管中,调节液面至8.00mL处④滴定待测液至滴定终点时,滴定管的液面读数18.00 mL
【小题3】如何知道滴定到达终点?
【小题4】下列操作会导致测定结果偏低的是
| A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定 |
| B.锥形瓶用蒸馏水洗涤后未用待测液润洗 |
| C.读取标准液读数时,滴定前平视,滴定到终点后俯视 |
| D.滴定前滴定管尖嘴处有气泡未排除,滴定后气泡消失 |
| A.托盘天平 | B.量筒 |
| C.碱式滴定管 | D.酸式滴定管 |
【小题6】FeSO4的质量分数为
 (2011?龙岩模拟)实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是( )
(2011?龙岩模拟)实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法错误的是( )