题目内容
【题目】下列物质中,含有极性键的共价化合物是
A. H2O2 B. CH3COONa C. Na2O2 D. I2
【答案】A
【解析】共价键是属于非金属元素之间形成的化学键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,只含有共价键的化合物是为共价化合物,以此来解答。
A.H2O2中含O-H极性共价键和O-O非极性共价键,只含共价键,为共价化合物,故A选;B.CH3COONa中含有离子键,为离子化合物,故B不选;C.Na2O2既含有非极性共价键,又含有离子键,为离子化合物,故C不选;D.I2中只含I-I非极性共价键,为单质,故D不选;故选A。

【题目】下表为元素周期表中的一部分,列出10种元素在周期表中的位置。用化学符号回答下列各题。
主族 周期 | ||||||||
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,化学性质最不活泼的是______(元素符号)。
(2)①③⑤三种元素最高价氧化物对应的水化物中,碱性最强的是____(写碱的化学式)。
(3)②③④三种元素形成的离子中,离子半径由大到小的顺序是________(用离子符号表示)。
()元素⑦的氢化物的化学式为____;该氢化物常温下和②单质反应的化学方程式是________;若该氢化物和元素⑧的单质反应,则化学方程式为___________。
(5)⑧的最高价氧化物对应水化物的化学式为__;①和⑧两元素形成化合物的电子式为___,该化合物灼烧时火焰颜色为____;①和⑨两元素形成化合物的溶液与元素⑧的单质反应的离子方程式为_____。
(6)⑤的最高价氧化物属于____氧化物(填“碱性”.“酸性”或“两性”),①和⑤元素最高价氧化物对应水化物相互反应的离子方程式为__________。
【题目】(1)汽车尾气中的主要污染物是NO、NO2和CO。用NaOH溶液可吸收NO、NO2,当n(NO)﹕n(NO2)=1时只生成一种盐,这种盐的化学式为__________。
(2)金属铬(Cr)的英文是Chromium,原意是颜色,因为它的化合物都有美丽的颜色。如表是几种常见铬的化合物或离子的水溶液的颜色:
离子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | CrO2- | CrO42- |
颜色 | 橙色 | 灰蓝色 | 蓝紫色 | 绿色 | 黄色 |
含铬元素的化合物可以发生如图一系列变化:
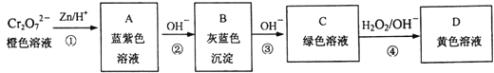
①写出反应④的离子方程式:______________________________________。
②结合上述转化图及所学知识,请分析向NaCrO2溶液中逐滴加入过量稀硫酸的现象为______。
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。
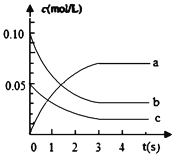
(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。