题目内容
【题目】(1)COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________,中心原子的杂化方式为__________________。
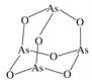
(2)As4O6的分子结构如图所示,其中As原子的杂化方式为______________。
(3)AlH4-中,Al原子的轨道杂化方式为__________;列举与AlH4-空间构型相同的一种离子和一种分子:__________、__________(填化学式)。
(4)用价层电子对互斥理论推断SnBr2分子中,Sn原子的轨道杂化方式为____________,SnBr2分子中Br-Sn-Br的键角________120°(填“>”“<”或“=”)。
【答案】3∶1 sp2 sp3 sp3 NH4+ CH4 sp2 <
【解析】
(1)根据1个单键是1个δ键,1个双键中含有1个δ键,1个π键以及COCl2分子的结构式来解答;
(2)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;
(3)AlH4-中Al原子孤电子对数=![]() =0,杂化轨道数目=4+0=4;互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷,可以用N原子与1个单位正电荷替换Al原子。
=0,杂化轨道数目=4+0=4;互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷,可以用N原子与1个单位正电荷替换Al原子。
(4)先判断价层电子对数目判断杂化类型,中心原子的孤电子对对成键电子对有排斥作用进而判断分子中Sn-Br的键角。
(1)COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3:1,中心原子C电子对数=3+![]() =3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
=3,故中心原子杂化方式为sp2,故答案为:3:1;sp2;
(2)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化;故答案为:sp3;
(3)AlH4-中Al原子孤电子对数=![]() =0,杂化轨道数目=4+0=4,Al原子杂化方式为:sp3,互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷:CH4,可以用N原子与1个单位正电荷替换Al原子:NH4+,故答案为:sp3;NH4+;CH4;
=0,杂化轨道数目=4+0=4,Al原子杂化方式为:sp3,互为等电子体的微粒空间构型相同,与AlH4-空间构型相同的离子,可以用C原子替换Al原子则不带电荷:CH4,可以用N原子与1个单位正电荷替换Al原子:NH4+,故答案为:sp3;NH4+;CH4;
(4)SnBr2分子中Sn原子价层电子对个数=2+![]() ×(4-2×1)=3,所以Sn原子的轨道杂化方式为sp2杂化,且含有一个孤电子对,所以该分子为V形分子,孤电子对对成键电子对有排斥作用,所以其键角小于120°,故答案为:SP2杂化;<。
×(4-2×1)=3,所以Sn原子的轨道杂化方式为sp2杂化,且含有一个孤电子对,所以该分子为V形分子,孤电子对对成键电子对有排斥作用,所以其键角小于120°,故答案为:SP2杂化;<。

【题目】表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | HClO | H2CO3 |
Ka | 1.8×10﹣5 | 3.0×10﹣8 | Ka1=4.1×10﹣7 Ka2=5.6×10﹣11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时溶液中c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
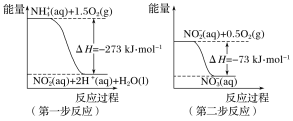
①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。






