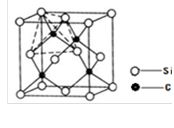
题目内容
金属晶体的形成是因为晶体中主要存在 ( )
| A.金属离子之间的相互作用 | B.金属原子之间的作用 |
| C.金属离子与自由电子间的相互作用 | D.金属原子与自由电子间的相互作用 |
C
解析试题分析:金属晶体中主要存在金属离子已经自由移动的电子。故本题选择C选项。
考点:化学键与晶体结构

练习册系列答案
相关题目
下列物质熔沸点高低比较正确的是
| A.SiO2<CO2 | B.CCl4<CF4 | C.NaCl<HCl | D.HF>HCl |
由碳原子构成的纳米碳管可以作为储存氢气的优良容器,其单层部分结构示意图如下,下列说法正确的是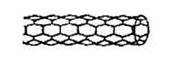
| A.纳米碳管是一种无机化合物 |
| B.纳米碳管中碳原子间以共价键结合 |
| C.纳米碳管与石墨互为同位素 |
| D.0.12g纳米碳管中含有6.02×l022个碳原子 |
下列有关说法正确的是( )
| A.乙醇与浓硫酸170℃共热,制得的气体直接通入溴水,可检验制得的气体是否为乙烯 |
| B.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可提高氨的产率 |
| C.将(NH4)2Fe(SO4)2·6H2O溶于稀硝酸,滴加KSCN溶液出现血红色,说明试样已变质 |
| D.由ⅠA族和ⅦA族的元素形成的离子晶体,晶体的结构完全相同 |
关于晶体的下列说法正确的是
| A.晶体中只要有阴离子就一定有阳离子 |
| B.晶体中只要有阳离子就一定有阴离子 |
| C.原子晶体的熔点一定比金属晶体的高 |
| D.分子晶体的熔点一定比金属晶体的低 |
物质的熔沸点高低能用键能大小解释的是
| A.Na > K | B.O2> N2 | C.H2O > H2S | D.SiO2 > CO2 |
某固体仅由一种元素组成,其密度为5.0 g·cm-3。用X射线研究该固体的结构时得知:在边长为10-7 cm的正方体中含有20个原子,则此元素的相对原子质量最接近于下列数据中的( )。
| A.32 | B.120 | C.150 | D.180 |
下列物质的熔、沸点高低顺序中排列正确的是 ( )
| A.金刚石>晶体硅>碳化硅 | B.CI4>CBr4>CCl4>CH4 |
| C.MgO>O2>N2>H2O | D.金刚石>生铁>纯铁>钠 |