题目内容
28.在1.00L 1.00mol·L-1NaOH溶液中通入16.8L标准状况下的CO2,计算所得溶液中含有的NaHCO3和Na2CO3的物质的量。
答案:
通入CO2的物质的量=![]() =0.750 mol
=0.750 mol
溶液中NaOH物质的量=1.00L×1.00 mol·L-1=1.00 mol
根据2NaOH+CO2=Na2CO3+H2O
2 : 1
该反应中CO2过量:0.750 mol-![]() =0.250 mol
=0.250 mol
生成的Na2CO3为![]() =0.500 mol
=0.500 mol
Na2CO3+CO2+H2O=2NaHCO3
1 : 1 : 2
反应中Na2CO3过量,生成的NaHCO3为n(反应的CO2)×2=0.500 mol
溶液中剩余的Na2CO3为0.500 mol-0.250 mol=0.250 mol

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
下列有关反应热的说法中正确的是( )
| A、一个化学反应是否能在常温下发生,与该反应的△H值的大小没有必然联系 | B、中和热△H=-57.3kJ?mol-1,所以1.00L 1.00mol?L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量 | C、用等体积的0.50mol?L-1盐酸、0.55mol?L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大 | D、在101kPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量是CH4的燃烧热 |
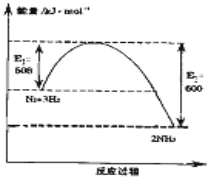 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家