题目内容
 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家
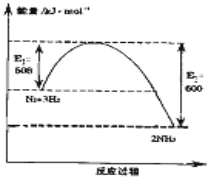
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔化学奖曾经有3次颁给研究氮气与氢气合成氨的化学家(1)如图表示温度为TK压强为P大气压是氮气与氢气合成氨反应过程中的能量变化,写出该反应的热化学方程式
(2)已知在TK温度下合成氨反应在2.00L的密闭容器中进行,得到如下数据:
| 时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
①0~1h内N2的平均反应速率为
②反应进行到2h时放出的热量为
③此条件下,反应:N2+3H2
| 催化剂 |
| 高温高压 |
④反应达到平衡后,若往平衡体系中再加入N2,H2和NH3各1mol,化学平衡移动的方向是
分析:(1)根据图计算出反应热,写出热化学方程式.注意物质状态,反应热符号等;
(2)①先根据生成的氨气的物质的量求出反应的氮气的物质的量,根据v(N2)=
=
求出0~1h内N2的平均反应速率v(N2);
②根据反应的热化学方程式、利用物质和能量的关系计算;
③由表中数据可知4h时反应达到平衡,然后利用平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
④根据浓度熵与平衡常数的关系判断方向.
(2)①先根据生成的氨气的物质的量求出反应的氮气的物质的量,根据v(N2)=
| △c |
| △t |
| ||
| △t |
②根据反应的热化学方程式、利用物质和能量的关系计算;
③由表中数据可知4h时反应达到平衡,然后利用平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
④根据浓度熵与平衡常数的关系判断方向.
解答:解:(1)①由图1可知,1molN2(g)与3molH2(g)完全反应生成2molNH3(g)的反应热为508kJ/mol-600kJ/mol=-92kJ/mol,所以合成氨的热化学反应方程式为:N2(g)+3H2(g)
2NH3(g)△H=-92kJ/mol,
故答案为:N2(g)+3H2(g)
2NH3(g)△H=-92kJ/mol,
(2)①生成的氨气的物质的量为0.20mol,反应的氮气的物质的量为0.10mol,0~1h内N2的平均反应速率v(N2)=
=
=
=0.05mol?L-1.h-1,
故答案为:0.05;
②由N2(g)+3H2(g)
2NH3(g)△H═-92kJ/mol,可知消耗1molN2产生92kJ的热量,而反应进行到2h时消耗0.3mol的氮气.所以反应进行到2h时放出的热量为92kJ×0.3=27.6KJ,故答案为:27.6;
③由表中数据可知4h时反应达到平衡,反应:N2+3H2
2NH3的化学平衡常数K=
=0.15,故答案为:0.15;
④反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各1mol,则此时各物质的浓度为:N2为0.5mol/L+0.5mol/L=1mol/L,H2为1.5mol/L+0.5mol/L=2mol/L,NH3为0.5mol/L+0.5mol/L=1mol/L,故浓度商Qc=
<0.15,故反应向正反应进行,故答案为:正反应.
| 高温高压 |
| 催化剂 |
故答案为:N2(g)+3H2(g)
| 高温高压 |
| 催化剂 |
(2)①生成的氨气的物质的量为0.20mol,反应的氮气的物质的量为0.10mol,0~1h内N2的平均反应速率v(N2)=
| △c |
| △t |
| ||
| △t |
| ||
| 1h |
故答案为:0.05;
②由N2(g)+3H2(g)
| 高温高压 |
| 催化剂 |
③由表中数据可知4h时反应达到平衡,反应:N2+3H2
| 催化剂 |
| 高温高压 |
| C2(NH3) |
| C(N2)C3(H2) |
④反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各1mol,则此时各物质的浓度为:N2为0.5mol/L+0.5mol/L=1mol/L,H2为1.5mol/L+0.5mol/L=2mol/L,NH3为0.5mol/L+0.5mol/L=1mol/L,故浓度商Qc=
| 12 |
| 1×23 |
点评:本题考查化学平衡知识,题目难度中等,注意把握化学平衡常数的意义以及热化学方程式的运用.

练习册系列答案
相关题目
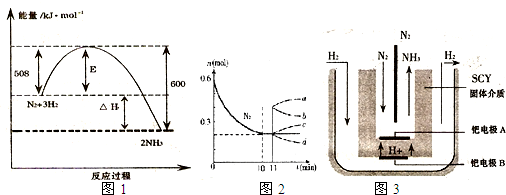

 2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。
2NH3,是哈伯于1905年发明的,但此法达到平衡时反应物的转化率不高。 2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为
2NH3的反应,左下图表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)=_______________。从11min起,压缩容器的体积为


