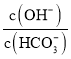题目内容
【题目】室温下,将![]()
![]() 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入的物质 | 结论 | |
A |
| 反应结束后, |
B |
| 溶液中 |
C |
| 由水电离出的 |
D |
| 反应完全后,溶液pH减小, |
A.AB.BC.CD.D
【答案】B
【解析】
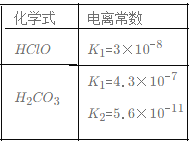
n(Na2CO3)=0.2mol,碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈碱性,水解方程式为CO32-+H2OHCO3-+OH-。
A.n(H2SO4)=2mol/L×0.1L=0.2mol,H2SO4和Na2CO3反应方程式为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,根据方程式知,二者恰好反应生成强酸强碱溶液Na2SO4,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得(Na+)=2c(SO42-),故A错误;
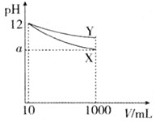
B.CaO+H2O=Ca(OH)2、Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,随着CO32-的消耗,CO32-+H2OHCO3-+OH-向左移动,c(HCO3-)减小,反应生成OH-,则c(OH-)增大,导致溶液中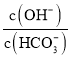 增大,故B正确;
增大,故B正确;
C.加水稀释,促进碳酸钠水解,则由水电离出的n(H+)、n(OH-)都增大,但氢离子、氢氧根离子物质的量增大倍数小于溶液体积增大倍数,c(H+)、c(OH-)减小,二者浓度之积减小,故C错误;
D.NaHSO4和Na2CO3反应方程式为:2NaHSO4+Na2CO3=Na2SO4+H2O+CO2↑,根据方程式知,二者恰好反应生成Na2SO4、H2O、CO2,溶液中的溶质是硫酸钠,溶液呈中性,溶液由碱性变为中性,溶液的pH减小,因为硫酸氢钠中含有钠离子,所以c(Na+)增大,故D错误;
故选B。

【题目】某校化学课外研究小组为验证浓硫酸与金属Zn反应产生的气体中含SO2和H2,进行了下列实验活动:
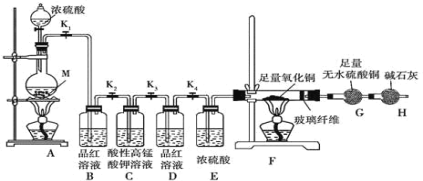
(1)在装入药品前,甲同学需检查装置_____。
(2)填写下表中的实验现象:_____。
装置 | B | F | G |
实验现象 |
(3)装置C的作用是_____,写出装置C中发生反应的离子方程式_____。
(4)装置D的作用是_____。
(5)SO2是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的SO2的含量。
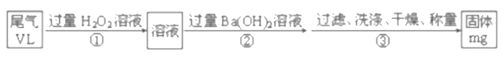
通过的尾气体积为VL(已换算成标准状况)时,该尾气中SO2含量(体积分数)为_____(用含有V、m的代数式表示)。
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛。 “铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?________(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为______________________________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入6mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
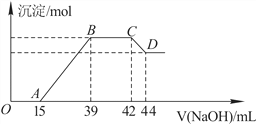
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:____________________
(2)图中OA段没有沉淀生成,此阶段发生反应的离子方程式为__________________。
(3)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为_____________;
(4)熔融物中铝元素的物质的量为________mol。
(5)B点对应的沉淀的物质的量为______mol,A点对应的氢氧化钠溶液的体积为________mL。