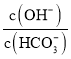题目内容
【题目】请写出满足以下要求的3个置换反应的化学方程式:___。
①所涉及的元素的原子序数都小于20;②6种单质分属6个不同的主族。
【答案】2Mg+CO2![]() 2MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2(氯气置换出硫单质、氯气置换出氮气等)
2MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2(氯气置换出硫单质、氯气置换出氮气等)
【解析】
常见的置换反应类型有金属置换非金属,金属置换金属,非金属置换非金属,非金属置换金属等类型,可以根据元素和化合物的知识并归纳中学阶段所有情况的置换反应来回答。
根据置换反应的特点以及参加反应的元素的要求,归纳中学阶段的置换反应,得出符合条件的反应可以是:2Mg+CO2![]() 2MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2,
2MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2,
故答案为:2Mg+CO2![]() 2MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2。
2MgO+C,2Al+6HCl=2AlCl3+3H2↑,2F2+2H2O=4HF+O2。

【题目】U、V、W、Y、Z是原子序数依次增大的短周期主族元素,U、Y在周期表中的相对位置如图;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
U | ||
Y |
(1)元素Z在周期表中位于第 ______ 族,我国首创以W组成的金属![]() 海水
海水![]() 空气电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使W组成的金属不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。则该电源负极反应为 ______
空气电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使W组成的金属不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。则该电源负极反应为 ______
(2)YO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VO,有关反应的离子方程式为 ______ ,由此可知YO2和VO还原性较强的是(写化学式)______。
(3)V的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 ______
![]() 一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是 ______(选填序号)。
一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变如表中反应条件x,该平衡体系中随x递增y递增的是 ______(选填序号)。
选项 | a | b | c | d |
x | 温度 | 温度 | 加入 | 加入甲的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时的甲的转化率 |
③向含4molV的最高价含氧酸的稀溶液中,逐渐加入Fe粉至过量。假设生成的气体只有一种,请在图中坐标系中画出n(Fe2+)随n(Fe)变化的示意图______

![]() 相同温度下,等体积、物质的量浓度都为
相同温度下,等体积、物质的量浓度都为![]() 的KZ和
的KZ和![]() 溶液的两种溶液中,离子总数相比较 ______
溶液的两种溶液中,离子总数相比较 ______
A.前者多![]() 一样多
一样多![]() 后者多
后者多![]() 无法判断.
无法判断.
【题目】丙烷、乙烯等有机物在工业上有广泛的应用,回答下列问题:
(1)已知:①C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) △H1
②C(石墨,s)+O2(g)= CO2(g) △H2
③2H2(g)+O2(g)= 2H2O(l) △H3
写出丙烷气体(C3H8)分解得到石墨(C)和氢气的热化学方程式:___。
(2)煤制乙烯包括合成气制备、合成气制甲醇、甲醇分解三步,则:
①生产合成气的反应:C(s)+H2O(g)=CO(g)+H2(g)在高温下能自发进行,则该反应的___(填选项)。
a.△H>0 △S>0 b.△H>0 △S<0
c.△H<0 △S>0 d.△H>0 △S<0
②用合成气制备甲醇的反应为:CO(g)+ 2H2(g)![]() CH3OH(g)(不发生其他反应)。四个容器中起始时压强、容积均相同,维持恒温,控制条件如下表;
CH3OH(g)(不发生其他反应)。四个容器中起始时压强、容积均相同,维持恒温,控制条件如下表;
编号 | 条件控制 | CO(g)/moL | H2(g)/moL | CH3OH(g)/moL |
A | 维持恒容 | 0.2 | 0.4 | 0 |
B | 维持恒容 | 0.1 | 0.2 | 0.1 |
C | 维持恒容 | 0.4 | 0.8 | 0 |
D | 维持恒压 | 0.4 | 0.8 | 0 |
达到平衡时,四个容器中甲醇的体积分数由大到小的关系是___(用字母表示)。
(3)在两个容积均为1L的密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H/span>2和CO2,在一定条件下发生反应:2CO2(g)+ 6H2(g)![]() C2H4(g)+ 4H2O(g)△H。CO2的平衡转化率α(CO2)与温度的关系如图所示。
C2H4(g)+ 4H2O(g)△H。CO2的平衡转化率α(CO2)与温度的关系如图所示。
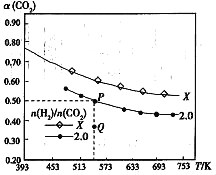
①此反应的平衡常数表达式K=___,P点对应温度下,K的值为___。
②该反应的△H___0(填“>”“<”或“=”),判断的理由是___。
③氢碳比:X___2.0(填“>”“<”或“=”)。
④在氢碳比为2.0时,Q点v(逆)___P点的v(逆)(填“>”“<”或“=”)。
【题目】室温下,将![]()
![]() 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入的物质 | 结论 | |
A |
| 反应结束后, |
B |
| 溶液中 |
C |
| 由水电离出的 |
D |
| 反应完全后,溶液pH减小, |
A.AB.BC.CD.D