题目内容
【题目】【化学选修3—物质结构与性质】
A、B、W、D、L为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W2-离子的结构示意图为__________,E元素在周期表中的位置为_________,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________。
(2)经测定A2W2为二元弱酸,A2W2的电子式为____________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式___________________。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀生成,当消耗2molI-时,共转移3mol电子,该反应的离子方程式是________________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式_____________,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_____________L(标准状况下)。
【答案】(1)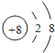 (1分),第三周期第ⅢA族;(2分)
(1分),第三周期第ⅢA族;(2分)
Al2O3+2OH﹣=2AlO2﹣+H2O;(2分)
(2)![]() (2分) BaO2+H2SO4=BaSO4↓+H2O2;(2分)
(2分) BaO2+H2SO4=BaSO4↓+H2O2;(2分)
(3)2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2;(2分)
(4)NaH+H2O=NaOH+H2↑,(2分) 56(2分)
【解析】试题分析:A、B、W、D、L为短周期元素,且原子序数依次增大,A、W能形成两种液态化合物A2W和A 2W2,则A为H,W为O,A、D同主族,D为Na,;进而可知D为Na,E元素的周期序数与主族序数相等,可知E为Al,再由五元素质子数之和为39可知B为C元素。
(1)W为8号元素O,O2-离子的结构示意图为 ,E为Al元素,Al有3个电子层,最外层有3个电子,在周期表中的位置为第三周期第ⅢA族,E的最高价氧化物为Al2O3,D的最高价氧化物的水化物为NaOH,氧化铝与NaOH溶液反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH﹣=2AlO2﹣+H2O。
,E为Al元素,Al有3个电子层,最外层有3个电子,在周期表中的位置为第三周期第ⅢA族,E的最高价氧化物为Al2O3,D的最高价氧化物的水化物为NaOH,氧化铝与NaOH溶液反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH﹣=2AlO2﹣+H2O。
(2)经测定H2O2为二元弱酸,H2O2为共价化合物,H2O2的电子式为![]() ,硫酸与BaO2反应生成H2O2,依据强酸制弱酸原理,可知反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
,硫酸与BaO2反应生成H2O2,依据强酸制弱酸原理,可知反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入H2O2,观察到溶液呈蓝色并有红褐色沉淀生成,说明H2O2能将KI氧化成碘单质,同时将Fe2+氧化成Fe(OH)3沉淀,根据题意消耗2molI-时,共转移3mol电子,根据得失电子守恒、电荷守恒和原子守恒配平,该反应的离子方程式是2Fe2++4I﹣+3H2O2=2Fe(OH)3↓+2I2;
(4)元素D的单质为金属Na,在一定条件下,Na能与H2化合生成化合物NaH,NaH能与水反应放出氢气,则该反应方程式为NaH + H2O =" NaOH" + H2↑,将1molNaH和1molAl混合加入足量的水,发生的反应依次为NaH+H2O=NaOH+H2↑、2Al+2NaOH+2H2O =2NaAlO2+3H2↑,得2Al+2NaH+4H2O=2NaAlO2+5H2↑,即可生成2.5molH2,体积为22.4L/mol×2.5mol=56L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录如下
表,其中记录合理的是
甲 | K2SO4、BaCl2、NH4NO3 |
乙 | NaCl、Ca(OH)2、K2CO3 |
丙 | HCl、Na2SO3、NaCl |
丁 | K2SO4、NaNO3、KCl |
A.甲 B.乙 C.丙 D.丁