题目内容
下列各组离子一定能大量共存的是( )
| A.在含大量Fe3+的溶液中:NH、Na+、Cl-、SCN- |
| B.在强碱性溶液中:Na+、K+、AlO、CO |
| C.在c(H+)=10-13 mol/L的溶液中:NH、Al3+、SO、NO |
| D.在pH=1的溶液中:K+、Fe2+、Cl-、NO |
B
试题分析:在含大量Fe3+的溶液中SCN-不能大量共存,A项错误;c(H+)=10-13 mol/L的溶液呈强碱性,NH、Al3+不能大量共存;在pH=1的溶液呈强酸性,Fe2+、NO不能大量共存。
点评:本题应该注意当溶液显酸性时NO3-具有强氧化性,还原性的离子不能在其中存在。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目

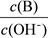 ②
②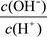 ③c(H+)
③c(H+)