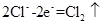题目内容
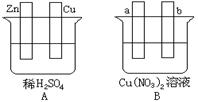
(12分)依据氧化还原反应:2Fe3+(aq)+Fe(s)=3Fe2+(aq),设计原电池并完成如图所示实验。请回答下列问题:
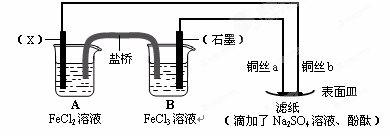
⑴电极X的材料是 ;石墨电极为电池的 极。
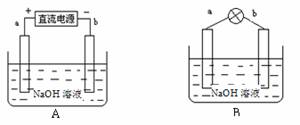
⑵B装置中发生的电极反应方程式为 ;表面皿中溶质Na2SO4的作用是 。
⑶铜丝b与滤纸接触处的现象为 ;此处电极反应方程式为: 。

⑴电极X的材料是 ;石墨电极为电池的 极。
⑵B装置中发生的电极反应方程式为 ;表面皿中溶质Na2SO4的作用是 。
⑶铜丝b与滤纸接触处的现象为 ;此处电极反应方程式为: 。
(1)铁 正 (2)Fe3++e-=Fe2+ 增强溶液的导电性
(3)滤纸变为红色 2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑
(3)滤纸变为红色 2H2O+2e-=H2↑+2OH-或2H++2e-=H2↑
(1)根据反应式可知,铁离子得到电子,是氧化剂。铁失去电子,是还原剂。由于A中溶液是氯化亚铁,所以X电极是铁,石墨电极是正极。
(2)原电池中正极得到电子,所以B中正极反应式是Fe3++e-=Fe2+;硫酸钠是强电解质,所以其作用是增强溶液的导电性。
(3)铜丝b和电源的负极相连,作阴极,溶液中的氢离子放电,生成氢气,电极反应式是2H++2e-=H2↑;由于氢离子放电,破坏了阴极周围水的电离平衡,所以阴极周围溶液显碱性,则滤纸变为红色。
(2)原电池中正极得到电子,所以B中正极反应式是Fe3++e-=Fe2+;硫酸钠是强电解质,所以其作用是增强溶液的导电性。
(3)铜丝b和电源的负极相连,作阴极,溶液中的氢离子放电,生成氢气,电极反应式是2H++2e-=H2↑;由于氢离子放电,破坏了阴极周围水的电离平衡,所以阴极周围溶液显碱性,则滤纸变为红色。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目