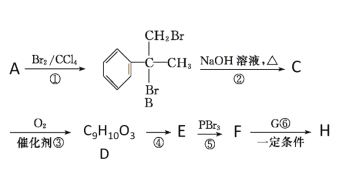
题目内容
【题目】常温下,改变0.1mol·L-1的富马酸(H2A)溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)[ δ(X)= ![]() ]随pH的变化如图所示。下列叙述正确的是( )
]随pH的变化如图所示。下列叙述正确的是( )
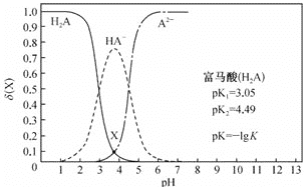
A.pH=3.05时,c(H2A)=c(HA-)=c(OH-)B.pH=4.0时, c(HA-)>C(H2A)>c(A2-)
C.常温下,反应HA-+OH-![]() A2-+H2O的pK=9.51D.常温下,图中x点处:1g
A2-+H2O的pK=9.51D.常温下,图中x点处:1g![]() =0.72
=0.72
【答案】D
【解析】
A.H2A的第一步电离平衡常数![]() , 当c(HA-)=c(H2A)时,K1=c(H+),由于pK1=3.05,因此可得当c(HA-)=c(H2A)时,c(H+)=10-3.05 , 此时溶液的pH=3.05,因此当溶液的pH=3.05时,c(H2A)=c(HA-)>c(OH-),故A错误;
, 当c(HA-)=c(H2A)时,K1=c(H+),由于pK1=3.05,因此可得当c(HA-)=c(H2A)时,c(H+)=10-3.05 , 此时溶液的pH=3.05,因此当溶液的pH=3.05时,c(H2A)=c(HA-)>c(OH-),故A错误;
B.由图可知,当溶液的pH=4.0时,溶液中离子浓度关系为:c(HA-)>c(A2-)>c(H2A),故B错误;
C.该反应的平衡常数![]() , 又水的离子积Kw=c(H+)×c(OH-),H2A的第二步电离平衡常数
, 又水的离子积Kw=c(H+)×c(OH-),H2A的第二步电离平衡常数![]() , 因此该反应的平衡常数
, 因此该反应的平衡常数![]() , 又pK2=4.49,因此K2=10-4.49, 常温下,Kw=10-14, 因此该反应的平衡常数
, 又pK2=4.49,因此K2=10-4.49, 常温下,Kw=10-14, 因此该反应的平衡常数![]() , 因此pK=-lgK=-lg109.51=-9.51,故C错误;
, 因此pK=-lgK=-lg109.51=-9.51,故C错误;
D.pK1=3.05,则K1=10-3.05, pK2=4.49,因此K2=10-4.49;由于X点时溶液中c(H2A)=c(A2-),因此![]() , 因此X点时溶液中
, 因此X点时溶液中![]() , 因此X点溶液中
, 因此X点溶液中![]() , 故D正确;
, 故D正确;
故答案为:D,

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案
相关题目