题目内容
【题目】某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作电极,槽中盛放含铬废水,原理示意图如下,下列说法不正确的是
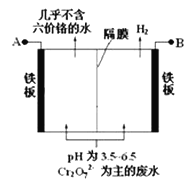
A. A为电源正极
B. 阴极区电极反应可能有:Cr2O72- + 6e- + 14H+ = 2Cr3++7H2O
C. 阳极区溶液中发生的氧化还原反应为:Cr2O72- +6Fe2+ +14H+ == 2Cr3+ +6Fe3+ + 7H2O
D. 若不考虑气体的溶解,当收集到H2 13.44 L(标准状况)时,装置中有0.1 mol Cr2O72-被还原
【答案】D
【解析】A.由图可知,右侧生成氢气,发生还原反应,右侧铁板为阴极,故左侧铁板为阳极,故A为电源正极,选项A正确;B.阴极氢离子放电生成氢气,氢离子浓度降低,溶液的pH增大,选项B错误;C.左侧铁板为阳极,铁放电生成亚铁离子,亚铁离子被溶液中的Cr2O72-氧化,反应生成Cr3+、Fe3+,反应的离子方程式为:Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O,选项C正确;D.13.44 L氢气的物质的量为![]() =0.6mol,根据电子转移守恒n(Fe2+)=
=0.6mol,根据电子转移守恒n(Fe2+)=![]() =0.6mol,根据Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×
=0.6mol,根据Cr2O72- +6Fe2+ +14H+ = 2Cr3+ +6Fe3+ + 7H2O可知,被还原的Cr2O72-的物质的量为0.6mol×![]() =0.1mol,选项D不正确。答案选D。
=0.1mol,选项D不正确。答案选D。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
![]()
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):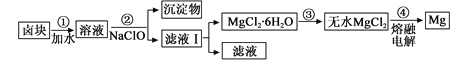
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因________。
④NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗
NaClO g。