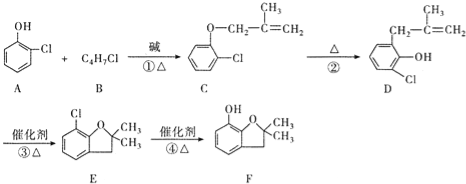
题目内容
【题目】有机物A是烃,有机物B易溶于水,且1 mol B能跟足量的钠反应生成标准状况下的H2 11.2 L,但不能与NaHCO3溶液反应,已知A通过如下转化关系可制得化学式为C4H8O2的酯E,且当D―→E时,相对分子质量增加28。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)反应①的原子利用率为________。
(2)B的密度比水________,B中含氧官能团的名称为________。
(3)反应②的化学方程式为________________________________。
(4)反应③的反应类型为______________________。
(5)4.4 g C物质完全燃烧消耗________ mol氧气。
(6)若D―→E时,式量增加m,则B的相对分子质量为__________ (用含m的代数式表示) 。
【答案】 100% 小 羟基 ![]() 取代反应(或酯化反应) 0.25 m+18
取代反应(或酯化反应) 0.25 m+18
【解析】有机物B易溶于水,且1molB能与足量的钠反应生成标准状况下的H211.2L,氢气为0.5mol,但不与NaHCO3溶液反应,故B分子含有1个-OH,D与B反应得到酯E的分子式为C4H8O2,属于饱和一元酯,由转化关系可知A、B、C、D分子中含有碳原子数目相等,结合E的分子式可知,A、B、C、D分子中均含有2个含有碳原子,故B为CH3CH2OH,烃A与水发生加成反应生成乙醇,A为CH2=CH2,B发生氧化反应生成C为CH3CHO,C反应氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3COOCH2CH3,则
(1)反应①是乙烯与水发生加成反应生成乙醇,原子利用率为100%;(2)B为乙醇,密度比水小,B中含氧官能团的名称为:羟基;(3)反应②是乙醇发生催化氧化生成乙醛,反应化学方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O;(4)反应③是乙酸与乙醇发生酯化反应生成乙酸乙酯,也属于取代反应;(5)4.4g C(乙醛)的物质的量为4.4g÷44g/mol=0.1mol,完全燃烧消耗氧气为0.1mol×(2+4/4-1/2)=0.25mol;(6)若D→E时是乙酸与醇转化生成酯,式量增加m,根据质量守恒定律,Mr(D)+Mr(B)=Mr(D)+Mr(水),则Mr(B)=Mr(D)-Mr(D)++Mr(水)=m+18。
2CH3CHO+2H2O;(4)反应③是乙酸与乙醇发生酯化反应生成乙酸乙酯,也属于取代反应;(5)4.4g C(乙醛)的物质的量为4.4g÷44g/mol=0.1mol,完全燃烧消耗氧气为0.1mol×(2+4/4-1/2)=0.25mol;(6)若D→E时是乙酸与醇转化生成酯,式量增加m,根据质量守恒定律,Mr(D)+Mr(B)=Mr(D)+Mr(水),则Mr(B)=Mr(D)-Mr(D)++Mr(水)=m+18。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案