题目内容
【题目】如图所示甲、乙是电化学实验装置:
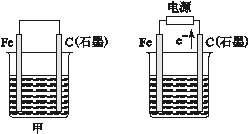 乙
乙
(1)若甲、乙两烧杯中均盛有NaCl溶液。
①甲中石墨棒上的电极反应式为_________________________________________________。
②乙中总反应的离子方程式为___________________________________________________。
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为_____。
(2))若甲、乙两烧杯中均盛有CuSO4溶液:
①甲中铁棒上的电极反应式为___________________________________________________。
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入_____________________(填写物质的化学式)______________g。
【答案】 O2+2H2O+4e-===4OH- 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 5Cl2+I2+6H2O===10HCl+2HIO3 Fe-2e-=Fe2+ CuO (或CuCO3) 0.8 (或1.24)
2OH-+H2↑+Cl2↑ 5Cl2+I2+6H2O===10HCl+2HIO3 Fe-2e-=Fe2+ CuO (或CuCO3) 0.8 (或1.24)
【解析】本题考查原电池的工作原理和电解原理,以及电极反应式的书写,(1)①甲中铁作负极,石墨作正极,发生吸氧腐蚀,石墨电极反应式为O2+2H2O+4e-=4OH-;②根据电子流动方向,铁作阴极,此装置是电解饱和食盐水,因此总电极反应式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;③Cl2作氧化剂,被还原成Cl-,I2为还原剂,根据得失电子数目守恒,因此有5×2×1=1×(x-0)×2,x=5,I被氧化成HIO3,因此反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;(2)①甲中发生Fe+Cu2+=Fe2++Cu,铁作负极,电极反应式为Fe-2e-=Fe2+;②乙中发生总反应是2CuSO4+2H2O
2OH-+H2↑+Cl2↑;③Cl2作氧化剂,被还原成Cl-,I2为还原剂,根据得失电子数目守恒,因此有5×2×1=1×(x-0)×2,x=5,I被氧化成HIO3,因此反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3;(2)①甲中发生Fe+Cu2+=Fe2++Cu,铁作负极,电极反应式为Fe-2e-=Fe2+;②乙中发生总反应是2CuSO4+2H2O![]() Cu+O2↑+2H2SO4,恢复到电解前的状态,需要加入CuO或CuCO3,pH=1此时溶液中n(H+)=200×10-3×0.1mol=0.02mol,如果加入CuO,则需要的m(CuO)=0.02×80/2g=0.8g,假如加入CuCO3,m(CuCO3)=0.02×124/2g=1.24g。
Cu+O2↑+2H2SO4,恢复到电解前的状态,需要加入CuO或CuCO3,pH=1此时溶液中n(H+)=200×10-3×0.1mol=0.02mol,如果加入CuO,则需要的m(CuO)=0.02×80/2g=0.8g,假如加入CuCO3,m(CuCO3)=0.02×124/2g=1.24g。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案