题目内容
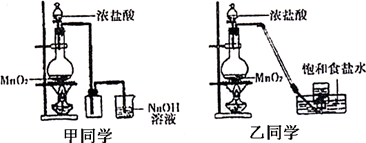
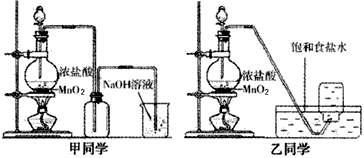
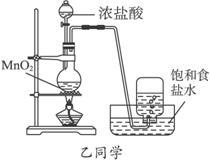
甲、乙两同学分别采取不同的方法各制取一瓶氯气,并用其验证Cl2与水反应产物的性质。甲同学采用课本介绍的装置,乙同学对课本装置进行了改进。甲、乙两同学采用的装置如下图所示: 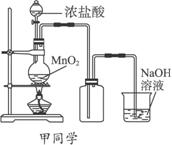
完成下列问题:
(1)写出实验中制备氯气的化学反应方程式:________________________________。
(2)对于乙同学的实验装置,要停止实验应怎样操作________________________。
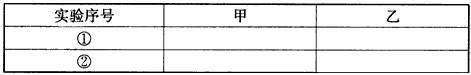
(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的两个实验。实验操作、现象、结论均相同。
记录如下:
实验序号 | 实验操作 | 现象 | 结论 |
① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
② | 加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物有较强的酸性 |
请你评价甲、乙两同学得出实验①②的结论是否合理?若不合理,请说明理由____________
_____________________________。
(4)丙同学查阅资料发现,HClO的氧化性大于MnO2,拟用下列四组试剂在实验室制取氯气:
A.CaCl2和次氯酸 B.浓盐酸和NaClO
C.浓盐酸和次氯酸 D.固体NaCl、固体NaClO和浓硫酸
你认为上述四组试剂中____________组试剂既符合实际,且Cl的利用率最高,写出这个反应的化学方程式:________________________________________________。
(1)MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)取出集气瓶后,立即将导管插入盛有NaOH溶液的烧杯中,然后停止加热
(3)乙同学的结论均正确。甲同学的结论①是正确的,结论②是不正确的,因为甲同学收集的氯气中含有大量的杂质气体HCl,溶于水时也会与NaHCO3粉末反应而产生气泡,这样就不能说明氯气与水反应的产物有较强的酸性
(4)D NaCl+NaClO+H2SO4====Na2SO4+Cl2↑+H2O(产物Na2SO4写为NaHSO4也可)
解析:验证Cl2与水反应产物的性质,关键在于要制取较纯净的氯气。氯气的制取应综合考虑:①反应物应减少水分,有利于气体的排出,丙应选D;②除杂(HCl),HCl对检验氯水的酸性有干扰,乙注意到了;③防污染(Cl2有毒),甲注意到了;④结束实验时乙应该将导管插入盛有NaOH溶液的烧杯中,然后停止加热。

| |||||||||||||||||||
为探究铜与浓硫酸的反应,甲、乙两同学分别设计了图1、图2所示装置,将足量铜和10 mL 18 mol·L-1浓硫酸共热,直到无气体生成为止(假定反应前后试管中溶液的体积不变)。
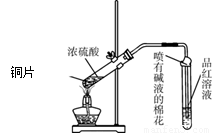

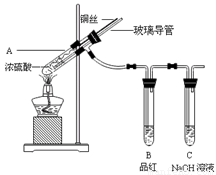 图1
图2
图1
图2
(1)比较两实验装置,图2装置的优点是:① ;② 。
(2)①甲根据所学的化学知识认为还有一定量的硫酸剩余。甲认为硫酸剩余的理论依据是 。
②下列药品中能够用来证明反应结束后的烧瓶中确有硫酸剩余的是_______。(选填编号)
A.过量铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)乙在拆除图2装置前,不打开胶塞,为使装置中的残留气体完全被吸收,应当采取的操作是 。
(4)为定量测定当剩余硫酸浓度不大于何值时,铜与硫酸就不能反应,甲、乙两位同学进行了如下设计:
①甲方案:将产生的气体缓缓通过预先称量过的盛有 的干燥管,反应结束后再次称量,干燥管质量增加m g。其余酸浓度为 mol·L-1。
②乙方案:分离出反应后的溶液并加蒸馏水稀释至1 000 mL,取20.00 mL于锥形瓶中,滴入2~3滴 ,(选填“酚酞”、“甲基橙”)用0.1000mol·L-1标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),用去NaOH溶液V mL。其余酸浓度为 mol·L-1。
③甲、乙两方案比较,你认为误差较大的是 ,理由是 。