题目内容
1774年瑞典化学家舍勒用软锰矿(主要成分是二氧化锰)和浓盐酸共热得到黄绿色气体。甲、乙两个同学分别采取上述反应原理,各制取一瓶氯气,并用其验证Cl2与水反应产物的性质。甲、乙同学采用的装置如图所示。回答下列问题
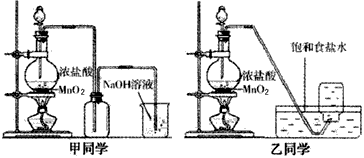
(1)写出实验中制备氯气的化学方程式____________________
(2)对于乙同学的实验装备,要停止实验,其操作顺序是___________。
①停止加热②取出集气瓶盖好③将导管伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的实验。实验操作、现象、结论记录如下
(2)对于乙同学的实验装备,要停止实验,其操作顺序是___________。
①停止加热②取出集气瓶盖好③将导管伸入到烧碱溶液中
(3)甲、乙两同学分别向收集到的氯气中加入适量的水,充分振荡后分成两份,均做验证氯气与水反应所得产物性质的实验。实验操作、现象、结论记录如下

请你填写下表评价甲、乙同学实验①、②的结论(填合理或不合理)
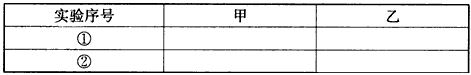
若不合理,理由是_______________________
(4)丙同学查阅资料发现HClO的氧化性大于MnO2,拟用下列四组试剂在实验室制取氯气
A.CaCl2和次氯酸 B.浓盐酸和NaClO C.浓盐酸和次氯酸 D.固体NaCl固体NaClO和浓硫酸
你认为上述四组试剂中____组试剂符合实际,且Cl的原子利用率又高;写出这个反应的化学方程式
________________________
(4)丙同学查阅资料发现HClO的氧化性大于MnO2,拟用下列四组试剂在实验室制取氯气
A.CaCl2和次氯酸 B.浓盐酸和NaClO C.浓盐酸和次氯酸 D.固体NaCl固体NaClO和浓硫酸
你认为上述四组试剂中____组试剂符合实际,且Cl的原子利用率又高;写出这个反应的化学方程式
________________________
(1)MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)②③①
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑ (2)②③①
(3)

理由:因为甲同学收集的氯气中含有大量的杂质气体HCl,溶于水时也会与NaHCO3粉末反应而产生气泡
(4)D;NaCl+NaClO+H2SO4=Na2SO4+Cl2↑+H2O(产物中Na2SO4写为NaHSO4也可)
(4)D;NaCl+NaClO+H2SO4=Na2SO4+Cl2↑+H2O(产物中Na2SO4写为NaHSO4也可)

练习册系列答案
相关题目