题目内容
10.工业上常用Na制备钛、钽、铌、锆等.如制钛,常有如下操作步骤,请完成其中的问题:(1)用90%浓H2SO4溶解钛铁矿(FeTiO3),反应方程式为、:
FeTiO3+3H2SO4═FeSO4+Ti(SO4)2+3H2O
在除去不溶性杂质后,结晶析出FeSO4•7H2O时,为保持较高的酸度不能加水,其原因可能为BC.
A.防止Fe2+被氧化
B.防止Ti(SO4)2水解
C.减少FeSO4•7H2O的溶解量
D.减少Ti(SO4)2的溶解量
(2)在除去杂质后,又需加大量水稀释以降低酸度,同时加热以生成TiO(OH)2沉淀,过滤,将TiO(OH)2热分解即得钛白粉(TiO2).除杂后加水稀释和加热的目的是促进Ti(SO4)2水解.
(3)在高温HCl气流中,TiO2可转化为TiCl4,反应方程式为TiO2+4HCl$\frac{\underline{\;高温\;}}{\;}$TiCl4+2H2O.
(4)将TiCl4与Na共熔即得Ti,反应方程式为TiCl4+4Na$\frac{\underline{\;\;△\;\;}}{\;}$Ti+4NaCl,若用TiCl4溶液与Na反应制Ti,则不能达到预期目的,原因是钠与TiCl4溶液反应时,钠首先与溶液中的水反应生成NaOH和氢气,不能达到预期目的.
分析 (1)制钛,在溶解钛铁矿后,最后是Ti(SO4)2的溶液,为了保持较高的酸度不能加水,显然是为了防止Ti(SO4)2水解,减少FeSO4•7H2O的溶解量.A.水无氧化性;B.防止Ti(SO4)2水解而被过滤掉;C.减少FeSO4•7H2O的溶解量,保证溶液中尽可能不含亚铁离子;D.加水不会减少Ti(SO4)2的溶解量;
(2)第二步中加水稀释,又加热,这样是促进Ti(SO4)2水解而制得TiO(OH)2沉淀,进而制TiO2,最后制得TiCl4;
(3)在高温HCl气流中,TiO2可转化为TiCl4,为TiO2与氯化氢反应生成四氯化钛和水;
(4)钠的金属活动性强于钛,TiCl4与Na共熔发生置换反应,生成Ti,若用TiCl4溶液与Na反应制Ti,钠首先与溶液中的水反应,不能反应制Ti.
解答 解:(1)在除去不溶性杂质后,结晶析出FeSO4•7H2O时,为保持较高的酸度不能加水,操作的目的为是通过结晶除去亚铁离子,防止Ti(SO4)2水解被过滤掉.
A.保持较高的酸度,不能防止Fe2+被氧化,水无氧化性加水与防止Fe2+被氧化无关,故A错误;
B.Ti(SO4)2为强酸弱碱盐,保持较高的酸度,可防止Ti(SO4)2水解,故B正确;
C.固体通常随溶剂的增加,溶解的溶质的质量在增加,加水能增加FeSO4•7H2O的溶解量,不加水可减少FeSO4•7H2O的溶解量,故C正确;
D.此时Ti(SO4)2的在溶液中,减少加水量与其溶解量无关,故D错误;
故答案为:BC;
(2)Ti(SO4)2为强酸弱碱盐,水解呈酸性,加大量水稀释以降低酸度,促进其水解,同时加热以生成更多的TiO(OH)2沉淀,将TiO(OH)2热分解即得钛白粉(TiO2),
故答案为:促进Ti(SO4)2水解;
(3)在高温HCl气流中,TiO2可转化为TiCl4,在高温的条件下,TiO2与氯化氢反应:TiO2+4HCl$\frac{\underline{\;高温\;}}{\;}$TiCl4+2H2O,
故答案为:TiO2+4HCl$\frac{\underline{\;高温\;}}{\;}$TiCl4+2H2O;
(4)钠的金属活动性强于钛,TiCl4与Na共熔发生:TiCl4+4Na$\frac{\underline{\;\;△\;\;}}{\;}$Ti+4NaCl,钠为活泼金属,能和水发生置换反应,反应为:2Na+2H2O=2NaOH+H2↑,若用TiCl4溶液与Na反应制Ti,钠首先与溶液中的水反应生成NaOH和氢气,不能达到预期目的,
故答案为:TiCl4+4Na$\frac{\underline{\;\;△\;\;}}{\;}$Ti+4NaCl;钠与TiCl4溶液反应时,钠首先与溶液中的水反应生成NaOH和氢气,不能达到预期目的.
点评 本题考查以钛铁矿为主要原料冶炼金属钛工艺流程,注意分析流程各反应物的转化是解答的关键,题目难度中等,侧重于考查学生的分析能力和对基础知识的应用能力.


(1)制备氯气选用的药品为漂粉精固体和浓盐酸,相关反应的化学方程式为Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)实验装置中B的作用是除氯气中的氯化氢,安全瓶作用.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是d(填编号).
| 编号 | a | b | c | d |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中发生反应的离子方程式为Cl2+SO32-+H2O=SO42-+2H+. 若亚硫酸钠溶液中的亚硫酸钠已有4%发生变质,则吸收336mL氯气,至少需要1mol•L-1的此亚硫酸钠溶液156mL.
| A. | 中子数为16的磷原子:${\;}_{15}^{31}$P | |
| B. | 质子数为17的氯原子:${\;}_{17}^{35}$Cl | |
| C. | 质量数为57的铁原子:${\;}_{57}^{26}$Fe | |
| D. | 核外电子数为16的硫原子:${\;}_{16}^{32}$S |

回答下列问题:
(1)检查装置气密性的方法是在仪器D的出气口连接导管,将导管的末端插入水槽中的水中,用酒精灯轻轻加热圆底烧瓶,若导管口有气泡冒出且停止加热后,在导管中形成一段水柱,说明装置气密性良好,a仪器的名称是分液漏斗
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式2NaNO2+(NH4)2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2N2↑+Na2SO4+4H2O;
(3)装置B的作用是除去氧气(及氮氧化物),装置C的作用是除去水蒸气;
(4)已知氮化硅的化学性质稳定,但常温下易溶于氢氟酸溶液生成一种白色的胶状沉淀和一种盐,请写出此化学反应方程式:Si3N4+4HF+9H2O=3H2SiO3↓+4NH4F;
(5)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Fe | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
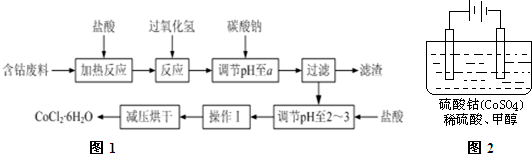
已知:①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2•6H2O熔点86℃,易溶于水;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.7 | 7.5 | 7.6 | 3.8 |
| 完全沉淀 | 3.2 | 9.7 | 9.2 | 5.2 |
(1)加入碳酸钠调节pH至a,a的范围是5.2~7.6.
(2)操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和过滤.
(3)制得的CoCl2•6H2O需减压烘干的原因是降低烘干温度,防止产品分解.
(4)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为减少有毒气体的排放,防止大气污染、防止产品中混有硝酸盐.原工艺较新工艺也有优点,其主要优点是流程的步骤减小,工艺减化.
(5)含钴物质在工业上有重要用途,有一种电化学法除去甲醇的污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中甲醇氧化成CO2而净化.实验室用如图2装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+.
②除去甲醇的离子反应为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是碳元素,当生产过程中产生标况下2.24LCO2时,共转移电子数为3.612×1023.
 A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同.已知:2NO2(g)?N2O4(g)△H<0.
A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同.已知:2NO2(g)?N2O4(g)△H<0. (Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算:
(Ⅰ)已知标准状况下,将1.12升氯化氢通入水中配成100毫升溶液,试计算: