题目内容
19.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.主要步骤如图: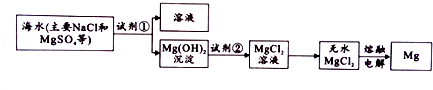
(1)为了使MgSO4转化为Mg(OH)2,试剂①物质类别为碱(填“酸”、“碱”、“盐”),反应的离子方程式为Mg2++2OH-=Mg(OH)2↓.
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀方法是过滤.
(3)将沉淀洗净,判断沉是否洗净的方法(或操作)是取最后一次洗涤液少许于试管,滴加足量稀硝酸,再加少量硝酸银溶液,若无白色沉淀生成,则已洗净,(或取最后一次洗涤液少许于试管,滴加足量稀盐酸,再加少量氯化钡溶液,若无白色沉淀生成,则已洗净).
(4)电解制取的镁块与金属铜连接导线,插入稀硫酸中形成原电池,写出该原电池负极的电极反应式Mg-2e-=Mg 2+.
分析 根据题中工业流程图可知,海水中加入碱,使镁离子沉淀,得到氢氧化镁,氢氧化镁溶于盐酸得氯化镁溶液,氯化镁溶液在酸性条件下蒸发得无水氯化镁,电解熔融的氯化镁可得镁,
(1)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂,根据元素守恒书写离子方程式;
(2)分离固体和液体用过滤,利用溶解性的差异来分析;
(3)根据氢氧化镁沉淀表面是否有氯离子或硫酸根离子可判断沉淀是否洗净;
(4)镁与铜连接导线,插入稀硫酸中形成原电池,镁是还原剂,与硫酸反应产生氢气,充当原电池的负极;
解答 解:(1)使MgSO4转化为Mg(OH)2,应选择碱,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓,
故答案为:碱;Mg2++2OH-=Mg(OH)2↓;
(2)过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,所以分离得到Mg(OH)2沉淀的方法是过滤,
故答案为:过滤;
(3)判断沉是否洗净的方法(或操作)是取最后一次洗涤液少许于试管,滴加足量稀硝酸,再加少量硝酸银溶液,若无白色沉淀生成,则已洗净,(或取最后一次洗涤液少许于试管,滴加足量稀盐酸,再加少量氯化钡溶液,若无白色沉淀生成,则已洗净),
故答案为:取最后一次洗涤液少许于试管,滴加足量稀硝酸,再加少量硝酸银溶液,若无白色沉淀生成,则已洗净,(或取最后一次洗涤液少许于试管,滴加足量稀盐酸,再加少量氯化钡溶液,若无白色沉淀生成,则已洗净);
(4)镁与铜连接导线,插入稀硫酸中形成原电池,镁是还原剂,与硫酸反应产生氢气,充当原电池的负极,电极反应式为,
故答案为:Mg-2e-=Mg 2+.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
9.下列实验操作中正确的是( )
| A. | 用浓硫酸配制稀硫酸时,浓硫酸缓慢加入水中,并用玻璃棒不断搅拌 | |
| B. | 用酒精和汽油都可以萃取碘水中的碘 | |
| C. | 用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干再停止加热 | |
| D. | 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
10.某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体.在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中不正确的是( )
| A. | NH5属于离子晶体 | |
| B. | NH5中存在共价键 | |
| C. | NH5与水反应是非氧化还原反应 | |
| D. | NH5与NH3溶于水后所得溶液均为碱性 |
7.实验中需2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取NaCl的质量分别( )
| A. | 1000mL,117g | B. | 950mL,111.2 g | C. | 任意规格,117g | D. | 500mL,111.2g |
14.短周期元素W、X、Y、Z在元素周期表中的位置如右图所示.其中Z的单质是一种重要半导体材料,广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族.
(2)Z的原子结构示意图为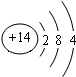 .
.
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH-)=2×10-4 mol•L-1(填计算数值,已知:T℃,Ksp[Y(OH)n]=4.0×l0-12).
| W | X | ||
| Y | Z |
(2)Z的原子结构示意图为
 .
.(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;C转化生成D的离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(5)表中Y的最高价氧化物对应水化物的化学式为Y(OH)n,在T℃时,其饱和溶液能使酚酞试液变红,原因是其溶液中的c(OH-)=2×10-4 mol•L-1(填计算数值,已知:T℃,Ksp[Y(OH)n]=4.0×l0-12).
11.“对氨基苯甲酸丁酯”是防晒霜中能吸收紫外线的防晒剂.下列关于“对氨基苯甲酸丁酯”的说法中正确的是( )
| A. | 从有机物分类看,它可属于氨基酸类、酯类、芳香类 | |
| B. | 它能与盐酸反应,但不能与苛性钠溶液反应 | |
| C. | 甲酸丁酯基(-COOC4H9)有三种同分异构体 | |
| D. | 它的分子式为C11H15NO2 |
 .
.