题目内容
19.下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).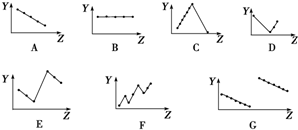
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数B.
(2)第三周期元素的最高化合价C.
(3)ⅠA族元素金属单质熔点A.
(4)第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径E.
(5)第二、三周期元素随原子序数递增原子半径的变化G.
分析 (1)同一主族元素价电子数相等,与原子序数无关;
(2)第三周期元素的最高正化合价随着原子序数增大而增大,稀有气体除外;
(3)IA族金属元素单质熔点随着原子序数增大而减小;
(4)电子层数越多,离子半径越大,电子层结构相同的离子其离子半径随着原子序数增大而减小;
(5)电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
解答 解:(1)同一主族元素价电子数相等,与原子序数无关,第IIA族元素价电子数都是2,故答案为:B;
(2)第三周期元素的最高正化合价随着原子序数增大而增大,稀有气体除外,所以化合价从+1升高到+7,稀有气体为0价,C符合;
故答案为:C;
(3)IA族金属元素单质的熔点与其原子半径成反比,所以碱金属族单质的熔点随着原子序数增大而减小,
故答案为:A;
(4)电子层数越多,离子半径越大,电子层结构相同的离子其离子半径随着原子序数增大而减小,则Na+、Mg2+、Al3+的离子半径依次减小,P3-、S2-、Cl-的离子半径依次减小,阴离子半径大于阳离子半径,
故答案为:E;
(5)部分短周期元素的原子半径,电子层数越大其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,故G符合,
故答案为:G.
点评 本题考查原子结构和元素性质,侧重考查元素周期律,熟练掌握同一周期、同一主族元素性质变化规律,并灵活运用这些规律解题,注意规律中的异常现象,题目难度不大.

练习册系列答案
相关题目
9.下列物质不含共价键的是( )
| A. | H2O | B. | KOH | C. | NaCl | D. | NH4Cl |
10.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->Cl->Br-
④稳定性:HCl>H2S>PH3.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
③还原性:F->Cl->Br-
④稳定性:HCl>H2S>PH3.
| A. | 都正确 | B. | ①②③ | C. | ②③④ | D. | ①②④ |
7.有人欲配制下列含有四种不同阴、阳离子的溶液,其中能配制成功的是( )
| A. | K+、H+、SO42-、CO32- | B. | Na+、Ca2+、SO42-、NO3- | ||
| C. | Ag+、Mg2+、Cl-、S2- | D. | Na+、Cu2+、Cl-、SO42- |
11.下列装置、试剂选用或操作正确的是( )
| A. | 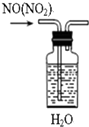 除去NO中的NO2 | B. | 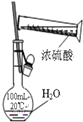 稀释浓硫酸 | ||
| C. |  实验室制取NH3 | D. | 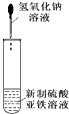 制备氢氧化亚铁并观察其颜色 |
1.某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验.
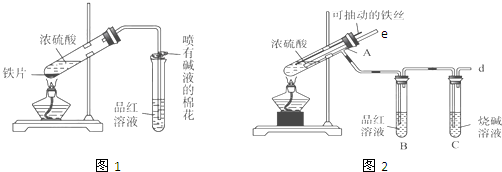
(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:

(1)能说明有SO2气体产生的实验现象是B中品红溶液褪色.
(2)图2中导气管e的主要作用为停止加热时,能防止倒吸或平衡压强.
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:2KMnO4+5SO2+2H2O=K2SO4+2MnSO4+2H2SO4.
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是便于控制反应的发生和停止.
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+.
为确认溶液的成分,选用如下试剂:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.酸性KMnO4溶液E.NaOH溶液 F.H2O2溶液
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色有明显变化,则说明Ⅱ成立. (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立. |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性高锰酸钾溶液 | 如果滴加酸性高锰酸钾溶液后溶液的紫红色褪色,则说明溶液中含有亚铁离子,说明Ⅲ成立;如果滴加酸性高锰酸钾溶液后溶液紫红色不褪,则说明溶液中没有亚铁离子,说明Ⅰ成立. |
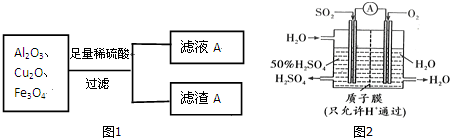
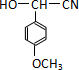
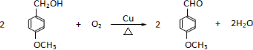
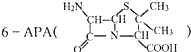 是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图:
是青霉素类抗生素的母核,与有机物F缩合生成阿莫西林.某同学用对甲基苯酚为原料设计阿莫西林的合成路线如图: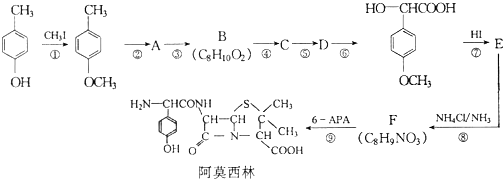
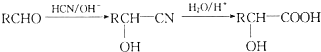
 .
. .
.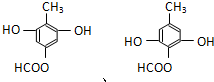 .
.