题目内容
【题目】“812”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 .
A.水
B.干冰
C.细沙
D.泡沫灭火器
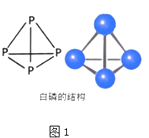
(2)白磷有毒能和氯酸(HClO3溶液发生反应生成一种常见的强酸和一种三元酸,氧化剂是 , 氧化产物是 , 1mol P4参加反应转移mol电子.
(3)钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题.
①钠比锂活泼,用原子结构解释原因 .
②钠电池“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间
由钠离子导体制作的陶瓷管相隔.写出该电池的正极反应: . 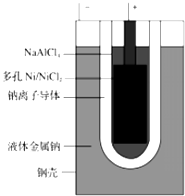
【答案】
(1)C
(2)HClO3或氯酸;H3PO4或磷酸;20
(3)最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强;NiCl2+2e﹣=Ni+2Cl﹣
【解析】解:(1)Na、K能和水反应生成氢气,在氧气中燃烧生成过氧化物,过氧化钠和水、二氧化碳反应都生成氧气,促进钠、钾燃烧,所以应该采用细沙灭火,所以答案是:C;(2)该反应中,P元素化合价由0价变为+5价、Cl元素化合价由+5价变为﹣1价,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,所以HClO3是氧化剂、H3PO4是氧化产物;
若有1mol P4参加反应转移电子物质的量=1mol×4×(5﹣0)=20mol;
所以答案是:HClO3或氯酸;H3PO4或磷酸; 20;(3)①同一主族元素的原子Na、Li,原子半径越大,金属活泼性越强,即钠比锂活泼,
所以答案是:最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强;
②ZEBRA电池的正极上发生得电子的还原反应,即NiCl2+2e﹣=Ni+2Cl﹣ ,
所以答案是:NiCl2+2e﹣=Ni+2Cl﹣ .
【考点精析】本题主要考查了碱金属的性质的相关知识点,需要掌握原子半径为同周期最大,易失电子.强还原剂且从Li→Cs金属性增强;取高价氧化物的水化物呈强碱性,从Li→Cs碱性增强才能正确解答此题.

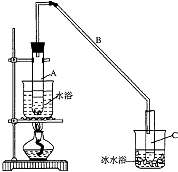
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯 已知: 
密度(g/cm3) | 熔点 (℃) | 沸点 (℃) | 溶解性 | |
环已醇 | 0.96 | 25 | 161 | 能溶于水 |
环已烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品 将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品.
①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用(填入编号)洗涤.
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯蒸馏即可得到精品.