题目内容
短周期元素甲、乙、丙、丁的原子序数依次增大.甲的最高价氧化物与乙的氢化物同时通入水中,得到的生成物既可与酸反应又可与碱反应.丙位于第ⅠA族,丁原子的核外电子总数是其最外层电子数的3倍.则( )
| A、气态氢化物的稳定性:乙<丁 | B、原子半径:甲<乙 | C、丙的两种氧化物都是离子化合物 | D、甲、乙、丁的最高价氧化物对应的水化物酸性依次增强 |
分析:短周期元素甲、乙、丙、丁的原子序数依次增大.乙与氢元素形成氢化物,则乙一定不能处于第一周期,丙位于第ⅠA族,再结合原子序数可知,丙为Na,故甲、乙位于第二周期,甲的最高价氧化物与乙的氢化物同时通入水中得到的生成物既可与酸反应又可与碱反应,该生成物应为弱酸的含氧酸铵盐,可推知甲为C、乙为N;丁位于第三周期,令丁原子最外层电子数为x,原子的核外电子总数是其最外层电子数的3倍,则2+8+x=3x,解得x=5,故丁为P,据此解答.
解答:解:短周期元素甲、乙、丙、丁的原子序数依次增大.乙与氢气形成氢化物,则乙一定不能处于第一周期,丙位于第ⅠA族,再结合原子序数可知,丙为Na,故甲、乙位于第二周期,甲的最高价氧化物与乙的氢化物同时通入水中得到的生成物既可与酸反应又可与碱反应,该生成物应为弱酸的含氧酸铵盐,可推知甲为C、乙为N;丁位于第三周期,令丁原子最外层电子数为x,原子的核外电子总数是其最外层电子数的3倍,则2+8+x=3x,解得x=5,故丁为P,则:
A.同主族自上而下非金属性减弱,非金属性越强氢化物越稳定,非金属性N>P,故氢化物稳定性NH3>PH3,故A错误;
B.同周期原子半径从左向右减小,则原子半径为C>N,故B错误;
C.Na对应的氧化物氧化钠、过氧化钠都是离子化合物,故C正确;
D.同主族自上而下非金属性减弱,非金属性越强最高价含氧酸的酸性越强,故酸性硝酸>磷酸,碳酸为弱酸、磷酸为中强酸、硝酸为强酸,故D错误,
故选:C.
A.同主族自上而下非金属性减弱,非金属性越强氢化物越稳定,非金属性N>P,故氢化物稳定性NH3>PH3,故A错误;
B.同周期原子半径从左向右减小,则原子半径为C>N,故B错误;
C.Na对应的氧化物氧化钠、过氧化钠都是离子化合物,故C正确;
D.同主族自上而下非金属性减弱,非金属性越强最高价含氧酸的酸性越强,故酸性硝酸>磷酸,碳酸为弱酸、磷酸为中强酸、硝酸为强酸,故D错误,
故选:C.
点评:考查元素周期律及元素对应的单质、化合物的性质,元素的推断是解答本题的关键,注意掌握既能与酸又能与碱反应的物质,难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,它们的部分化合价如下表,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 最高正价或最低负价 | -4 | +1 | +4 | -2 | -1 |
| A、乙的单质中能与水剧烈反应 |
| B、气态氢化物的稳定性:丙>甲 |
| C、丙的氧化物能与戊的氢化物水溶液反应 |
| D、其最高价氧化物对应的水化物的酸性:丁>戊 |
短周期元素甲、乙、丙、丁在元素周期表的相对位置如表所示,其中甲的气态氢化物的水溶液呈碱性,则下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 |
| A、甲位于元素周期表中第2周期、第ⅤA族 |
| B、原子半径:甲>乙 |
| C、单质的氧化性:丙>乙 |
| D、气态氢化物稳定性:丁>丙>乙 |
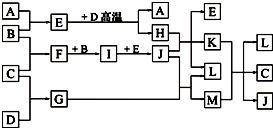 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).