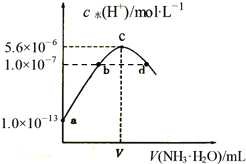
题目内容
【题目】A、B两种酸溶液pH都是2,各取1mL分别加水稀释成1000mL,其pH的变化如图所示,则下列判断正确的是( )
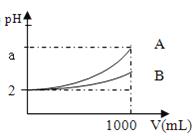
A.原酸溶液的浓度c(A)=c(B)
B.若a=5,则B为强酸,A为弱酸B
C.原酸溶液的浓度c(A)>c(B)
D.若a<5,则A、B都是弱酸
【答案】D
【解析】
pH=2的两种酸稀释1000倍时,弱酸中存在电离平衡,加水稀释促进弱电解质电离,导致溶液的pH小于5,强酸溶液的pH=5,稀释过程中,弱酸的电离导致稀释后溶液的pH小于强酸的变化程度,根据图象知,A的酸性大于B。
A.根据图象知,A酸pH变化大,B酸pH变化小,说明A的酸性大于B,pH相等的两种酸,弱酸的浓度大于强酸,所以原酸溶液的浓度c(A)<c(B),故A错误;
B.若a=5,稀释1000倍后氢离子浓度变为原来的千分之一,所以A为强酸,B的pH小于A,说明B中存在电离平衡,则B为弱酸,故B错误;
C.由A项分析可知,原酸溶液的浓度c(A)<c(B),故C错误;
D.若a<5,说明两种酸中都存在电离平衡,则A、B都是弱酸,故D正确;
故答案为D。

练习册系列答案
相关题目
【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
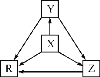
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D