题目内容
氮及其化合物在工农业生产、生活中有着重要作用。
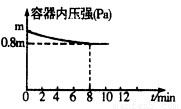
(1)在T℃时,将0.6molH2和0.4molN2置于容积为2 L的密闭容器中(压强为mPa)发生反应:3H2+N2 2NH3? △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为??? mol·L-1·min-1。
2NH3? △H<0。若保持温度不变,某兴趣小组同学测得反应过程中容器内压强随时间变化如图所示:8 min内分钟NH3的平均生成速率为??? mol·L-1·min-1。
(2)仍在T℃时,将0.6molH2和0.4molN2置于一容积可变的密闭容 器中。
①下列各项能说明该反应已达到平衡状态的是?????? (填序号)。
a.容器内N2、H2、NH3的浓度之比为l:3:2
b.3v正(N2)=v逆(H2)
c.3v正(H2)=2v逆(NH3)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比 ??????? (填“变大”“变小”或“不变”)。
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改 变的条件可能是????????? 。
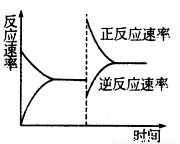
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。??? 氨气能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)??  H=-akJ·mol-1
H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)?  H=-bkJ·mol-1
H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:?????????????? 。
若标准状况下NO与NO2混合气体40.32L被足量氨水完全吸收,产生标准状况下氮气42.56L。该混合气体中NO与NO2的体积之比为??????? 。
(1)0.0125;(2)①bde;②变大;③c;
(3)8NH3(g)+6NO2(g)=7N2(g)+12H2O(g)?? △H=—(6a+7b)/5kJ·mol-1;1:2。
【解析】
试题分析:(1)分析题给图像知,反应体系中的压强由起始状态的m变为平衡状态的0.8m,根据阿伏加德罗定律:在等温等容的条件下,气体的压强之比等于气体的物质的量之比知,容器内气体的总物质的量为反应前的1.0mol变为平衡后的0.8mol,气体的物质的量减少0.2mol;结合反应3H2+N2 2NH3 利用差量法分析知,生成气体减少的物质的量与生产氨气的物质的量的相等,为0.2mol,根据公式v=△n/V△t计算得8 min内分钟NH3的平均生成速率为0.0125mol·L-1·min-1;(2)① a.平衡时N2、H2、NH3的浓度之比不一定为l:3:2,错误;b.由3v正(N2)=v逆(H2)得v正(N2):v逆(H2)=1:3,等于化学计量数之比,正确;c.由3v正(H2)=2v逆(NH3)得v正(H2):v逆(NH3)=2:3,不等于化学计量数之比,错误;d.由于反应在容积可变的密闭容器中进行,混合气体的密度随反应的进行不断变化,当其保持不变时已达平衡,正确;e.容器中气体的平均相对分子质量不随时间而变化,已达平衡,正确,选bde;②合成氨的反应正向为气体物质的量减小的反应,等温等压条件下达到平衡与等温等容条件下达到平衡相比,相当于缩小容器的体积,平衡正向移动,NH3的体积分数变大;③a.升高温度,同时加压,v正、v逆同时增大,与图像不符,错误;b.降低温度,同时减压,v正、v逆同时减小,与图像不符,错误;c.保持温度、压强不变,向容器内充入氮气或氢气来增大反应物浓度,v正增大,容器内气体物质的量增大,为保持压强不变,容器体积增大,氨气浓度减小,v逆减小,达平衡后速率可能比原平衡大,正确;d.保持温度、压强不变,从容器内分离出氨气来减小生成物浓度,v逆减小,容器内气体物质的量减小,为保持压强不变,容器体积减小,反应物浓度增大,v正增大,根据等效平衡知识知,达平衡后速率与原平衡相等,与图像不符,错误,选c;(3)根据反应① 2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)?? △H=-akJ·mol-1
2NH3 利用差量法分析知,生成气体减少的物质的量与生产氨气的物质的量的相等,为0.2mol,根据公式v=△n/V△t计算得8 min内分钟NH3的平均生成速率为0.0125mol·L-1·min-1;(2)① a.平衡时N2、H2、NH3的浓度之比不一定为l:3:2,错误;b.由3v正(N2)=v逆(H2)得v正(N2):v逆(H2)=1:3,等于化学计量数之比,正确;c.由3v正(H2)=2v逆(NH3)得v正(H2):v逆(NH3)=2:3,不等于化学计量数之比,错误;d.由于反应在容积可变的密闭容器中进行,混合气体的密度随反应的进行不断变化,当其保持不变时已达平衡,正确;e.容器中气体的平均相对分子质量不随时间而变化,已达平衡,正确,选bde;②合成氨的反应正向为气体物质的量减小的反应,等温等压条件下达到平衡与等温等容条件下达到平衡相比,相当于缩小容器的体积,平衡正向移动,NH3的体积分数变大;③a.升高温度,同时加压,v正、v逆同时增大,与图像不符,错误;b.降低温度,同时减压,v正、v逆同时减小,与图像不符,错误;c.保持温度、压强不变,向容器内充入氮气或氢气来增大反应物浓度,v正增大,容器内气体物质的量增大,为保持压强不变,容器体积增大,氨气浓度减小,v逆减小,达平衡后速率可能比原平衡大,正确;d.保持温度、压强不变,从容器内分离出氨气来减小生成物浓度,v逆减小,容器内气体物质的量减小,为保持压强不变,容器体积减小,反应物浓度增大,v正增大,根据等效平衡知识知,达平衡后速率与原平衡相等,与图像不符,错误,选c;(3)根据反应① 2NH3(g)+5NO2(g)=7NO(g)+3H2O(g)?? △H=-akJ·mol-1
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)? △H=-bkJ·mol-1利用盖斯定律:(①×6+②×7)÷5得NH3直接将NO2还原为N2的热化学方程式为:③8NH3(g)+6NO2(g)=7N2(g)+12H2O(g)?? △H=—(6a+7b)/5kJ·mol-1;根据反应②和③列方程组计算;设NO的物质的量为x,NO2的物质的量为y,根据题意知,x+y=40.32/22.4mol=1.8mol,5/6x+7/6y=42.56/22.4mol=1.9mol解得x=0.6mol,y=1.2mol;则该混合气体中NO与NO2的体积之比为1:2。
考点:考查化学反应速率和化学平衡及相关图像、盖斯定律及根据化学方程式计算。

 2NH3(g)
2NH3(g)

 2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K=
2NH3(g),△H<0,其化学平衡常数K与t的关系如下表:(已知K= 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: