题目内容
【题目】将pH为5的硫酸溶液稀释500倍,稀释后溶液中c( ![]() ):c(H+)约为( )
):c(H+)约为( )
A.1:1
B.1:2
C.1:10
D.10:1
【答案】C
【解析】pH为5的溶液中氢离子浓度为:c(H+)=1×10﹣5mol/L,硫酸根离子的浓度为:c(SO42﹣)=5×10﹣6mol/L;
溶液稀释500倍后,氢离子浓度不可能小于1×10﹣7mol/L,只能无限接近1×10﹣7mol/L,而硫酸根离子浓度为:c(SO42﹣)=1×10﹣8mol/L,
所以稀释后溶液中硫酸根离子与氢离子浓度之比为:1×10﹣8mol/L:1×10﹣7mol/L=1:10,
故答案为:C.
根据溶液物质的量浓度的定义计算稀释后硫酸根离子的浓度,结合水的离子积常数计算稀释后氢离子的物质的量浓度,然后计算即可.

 阅读快车系列答案
阅读快车系列答案【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验.请你完成下列填空:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液.
Ⅱ.取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用的标准NaOH溶液进行滴定.重复上述滴定操作2~3次,记录数据如表.
实验编号 | NaOH溶液的浓度(mol/L) | NaOH溶液的体积 | 待测盐酸溶液的体积(mL) |
① | 0.10 | 20.00 | |
② | 0.10 | 18.56 | 20.00 |
③ | 0.10 | 18.54 | 20.00 |
(1)第1次实验滴定前液面在0刻度,滴定后如图所示,则第一次实验滴定完用去NaOH溶液的体积记录为mL
(2)根据上述数据,可计算出该盐酸的浓度为 .
(3)在上述实验中,下列操作会造成测定结果偏高的有
A.滴定终点时俯视读数
B.酸式滴定管使用前,水洗后未用待测稀盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液,定容时仰视
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
【题目】下图为实验室中某些气体的制备、除杂、收集装置。用此装置能获得干燥纯净气体的是
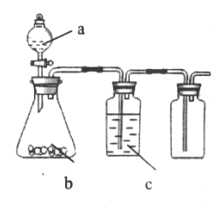
选项 | a | b | c | 气体 |
A | 浓盐酸 | Na2SO3 | 浓硫酸 | SO2 |
B | 稀硝酸 | Cu | 浓硫酸 | NO |
C | 浓盐酸 | MnO2 | 饱和食盐水 | Cl2 |
D | H2O2 | MnO2 | 浓硫酸 | O2 |
A. A B. B C. C D. D
【题目】一个原电池总反应为Zn+Cu2+=Zn2++Cu,该电池电极材料及电解质溶液可能是 ( )
选项 | 正极 | 负极 | 电解质溶液 |
A | Zn | Cu | CuCl2 |
B | Zn | Cu | H2SO4 |
C | Cu | Zn | CuSO4 |
D | Zn | Ag | CuSO4 |
A.AB.BC.CD.D

