题目内容
【题目】实验室进行二氧化硫制备与性质实验的组合装置(如图),部分固定装置未画出。
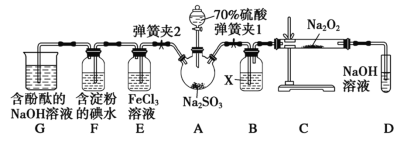
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是___,再往D中装水,然后微热A,观察到D中有气泡冒出,移开酒精灯,D中导气管中有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置B中试剂X是___,它的作用是___。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是___。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为___,发生反应的离子方程式是___。
(5)E中溶液由棕黄色变为浅绿色,写出发生反应的离子方程式。___
(6)G中含酚酞的NaOH溶液逐渐褪色,欲证明褪色的原因是SO2具有漂白性还是SO2溶于水显酸性。请设计实验___。
【答案】关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1 浓H2SO4 除去SO2中的水蒸气,防止水与Na2O2反应干扰实验 将带火星的木条放在试管口处,看木条是否复燃 F中溶液蓝色褪去 SO2+I2+2H2O=2I-+SO![]() +4H+ SO2+2Fe3++2H2O=SO
+4H+ SO2+2Fe3++2H2O=SO![]() +2Fe2++4H+ 取少量褪色后的溶液于试管中,滴加NaOH溶液,若变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,加热,若未变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,滴加酚酞试液,若未变红,则证明褪色的原因是SO2溶于水显酸性
+2Fe2++4H+ 取少量褪色后的溶液于试管中,滴加NaOH溶液,若变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,加热,若未变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,滴加酚酞试液,若未变红,则证明褪色的原因是SO2溶于水显酸性
【解析】
三颈烧瓶中亚硫酸钠固体和较浓硫酸发生反应放出SO2气体,经过B,二氧化硫被干燥,C装置中过氧化钠和二氧化硫发生氧化还原反应,D是吸收多余二氧化硫的装置,E中氯化铁和二氧化硫发生氧化还原反应,F中碘单质和二氧化硫发生氧化还原反应,G装置是后续探究褪色机理用的,据此回答;
(1)在组装好装置后,若要检验A~D装置的气密性,则需把相应的容器“密封”,故其操作是关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1,再往D中装水,接着再利用“热胀冷缩”原理进行检验;
答案为:关闭弹簧夹2和分液漏斗活塞,打开弹簧夹1;
(2)装置B中试剂X是液体干燥剂用于干燥SO2,通常是浓硫酸,它的作用是吸收二氧化硫气体中的水蒸气,防止水与Na2O2反应干扰实验;
答案为:浓H2SO4;除去SO2中的水蒸气,防止水与Na2O2反应干扰实验;
(3) SO2进入装置C中与Na2O2反应,则检验SO2与Na2O2反应是否有氧气生成的操作及现象是:将带火星的木条放在试管口处,看木条是否复燃;
答案为:将带火星的木条放在试管口处,看木条是否复燃;
(4)能说明I-还原性弱于SO2,即意味着SO2还原碘单质,则F中发生的现象为:溶液蓝色褪去;发生反应的离子方程式是SO2+I2+2H2O=2I-+SO![]() +4H+;
+4H+;
答案为:F中溶液蓝色褪去;SO2+I2+2H2O=2I-+SO![]() +4H+;
+4H+;
(5)E中溶液由棕黄色变为浅绿色,则Fe3+被SO2还原为Fe2+,则发生反应的离子方程式为SO2+2Fe3++2H2O=SO![]() +2Fe2++4H+;
+2Fe2++4H+;
答案为:SO2+2Fe3++2H2O=SO![]() +2Fe2++4H+;
+2Fe2++4H+;
(6) G中含酚酞的NaOH溶液逐渐褪色,褪色的原因可能是SO2具有漂白性,也可能是SO2溶于水显酸性中和了NaOH,那么可以这样做:取少量褪色后的溶液于试管中,滴加NaOH溶液,若变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,加热,若未变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,滴加酚酞试液,若未变红,则证明褪色的原因是SO2溶于水显酸性;
答案为:取少量褪色后的溶液于试管中,滴加NaOH溶液,若变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,加热,若未变红,则证明褪色的原因是SO2溶于水显酸性。或取少量褪色后的溶液,滴加酚酞试液,若未变红,则证明褪色的原因是SO2溶于水显酸性。

 阅读快车系列答案
阅读快车系列答案【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:
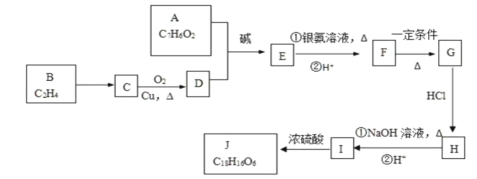
已知:
①有关A的信息如下:
能发生银镜反应 |
与FeCl3溶液发生显色反应 |
核磁共振氢谱显示有4组峰,峰面积之比为1:2:2:1 |
②R1-CHO+R2-CH2-CHO![]()
![]()
回答以下问题:
(1)A中含有的含氧官能团名称是________和________。
(2)写出反应类型:G→H:________、I→J:________。
(3)写出下列过程化学方程式。
①F→G的化学方程式__________________。
②B→C的化学方程式__________________。
(4)写出J的结构简式___________。
(5)结合题给信息,以D为原料经过三步反应制备1,3丁二烯,设计合成路线_________(其他试剂任选)。合成路线流程图示例:CH3CH2Cl![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3
CH3COOCH2CH3