题目内容
某化学小组进行Na2SO3的性质实验探究。
在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
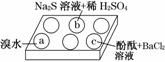
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
(1)a中实验现象证明Na2SO3具有________性。
(2)b中发生反应的离子方程式是_____________________________________________
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)_______________
________________________________________________________________________。
解析:(1)a中发生反应的化学 方程式为:Na2SO3+Br2+H2O===Na2SO4+2HBr,证明Na2SO3具有还原性。
方程式为:Na2SO3+Br2+H2O===Na2SO4+2HBr,证明Na2SO3具有还原性。
(2)b中产生淡黄色沉淀,发生反应的离子方程式是SO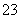 +2S2-+6H+===3S↓+3H2O。
+2S2-+6H+===3S↓+3H2O。
(3)滴入酚酞溶液变红是因为SO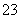 发生了水解反应而
发生了水解反应而 使溶液显碱性:SO
使溶液显碱性:SO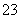 +H2OHSO
+H2OHSO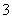 +OH-,再加入BaCl2溶液后,Ba2+与SO
+OH-,再加入BaCl2溶液后,Ba2+与SO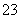 反应产生BaSO3沉淀,反应消耗了SO
反应产生BaSO3沉淀,反应消耗了SO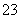 使其浓度减小,水解平衡向左移动,OH-浓度减小,红色褪去。
使其浓度减小,水解平衡向左移动,OH-浓度减小,红色褪去。
答案:(1)还原性 (2)SO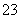 +2S2-+6H+===3S↓+3H2O
+2S2-+6H+===3S↓+3H2O
(3)在Na2SO3溶液中,SO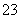 水解显碱性:SO
水解显碱性:SO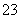 +H2OHSO
+H2OHSO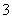 +OH-,所以滴入酚酞后溶液变红;在该溶液中加入 BaCl2后,Ba2++SO
+OH-,所以滴入酚酞后溶液变红;在该溶液中加入 BaCl2后,Ba2++SO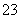 ===BaSO3↓(白色),由于c(SO
===BaSO3↓(白色),由于c(SO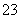 )减小,SO
)减小,SO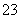 水解平衡左移,c(OH-)减小,红色褪去。
水解平衡左移,c(OH-)减小,红色褪去。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应方程式)____________
________________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________,写出发生反应的离子方程式________________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
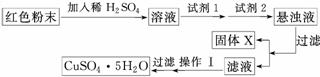

试回答:
①试剂1为________ (填字母,后同),试剂2为________。
(填字母,后同),试剂2为________。
②固体X的化学式为____________________________________________________。
③操作Ⅰ为___________________________________________________________。
 首先反应
首先反应

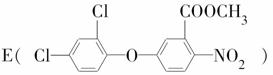
 导速度较慢,它是芽前除草剂,主要用于大豆除草。某烃A合成E的路线如下:A
导速度较慢,它是芽前除草剂,主要用于大豆除草。某烃A合成E的路线如下:A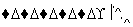
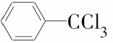
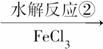
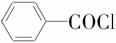
 B
B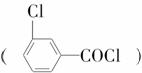

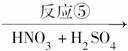 D
D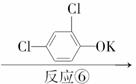
 _________________________;
_________________________; ____________________________________,
____________________________________,