题目内容
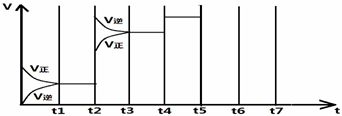
 某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题.
某温度时,在5L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.请通过计算回答下列问题.(1)反应开始至2min,Y的平均反应速率为
0.03mol/(L?min)
0.03mol/(L?min)
;(2)分析有关数据,写出X、Y、Z的反应方程式:
X+3Y?2Z
X+3Y?2Z
;(3)反应达到最大限度时,Y的转化率为
30%
30%
.分析:(1)据v=
计算反应速率;
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)转化率等于Y应的物质的量与初始物质的量的比.
| ||
| △t |
(2)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(3)转化率等于Y应的物质的量与初始物质的量的比.
解答:解:(1)反应开始至2 min时,Y的物质的量减少了1.0mol-0.7mol=0.3mol,所以反应速率是
=0.03mol/(L?min),
故答案为:0.03 mol/(L?min);
(2)根据图象可知X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,且分别是0.1mol、0.3mol、0.2mol,由于变化量之比是相应的化学计量数之比,所以其系数之比为0.1mol:0.3mol:0.2mol=1:3:2,所以其方程式为X+3Y?2Z,
故答案为:X+3Y?2Z;
(3)反应达到最大限度时,Y的物质的量减少了1.0mol-0.7mol=0.3mol,则Y的转化率=
×100%=30%,
故答案为:30%.
| 0.3mol |
| 5L×2min |
故答案为:0.03 mol/(L?min);
(2)根据图象可知X、Y的物质的量减小,Z的物质的量增加,则X和Y是反应物,Z是生成物,且分别是0.1mol、0.3mol、0.2mol,由于变化量之比是相应的化学计量数之比,所以其系数之比为0.1mol:0.3mol:0.2mol=1:3:2,所以其方程式为X+3Y?2Z,
故答案为:X+3Y?2Z;
(3)反应达到最大限度时,Y的物质的量减少了1.0mol-0.7mol=0.3mol,则Y的转化率=
| 0.3 |
| 1.0 |
故答案为:30%.
点评:本题考查了物质的量的有关计算,根据图象判断反应物和生成物及反应方程式,结合公式来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.
合成氨反应是“将空气变成面包”的反应,如果没有合成氨反应,地球将无法养活现在这么多的人.已知合成氨的反应为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1.