题目内容
联氨(N2H4)及其衍生物是一类重要的火箭燃料。N2H4与N2O4反应能放出大量的热。
(1)已知:2NO2(g)
 N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是
N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中此反应达到平衡。 其他条件不变时,下列措施不能使NO2转化率提高的是 | A.减少NO2的浓度 | B.降低温度 | C.增加NO2的浓度 | D.升高温度 |
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)="0.0300" mol·L-1、c(N2O4)="0.0120" mol·L-1。计算反应2NO2(g)
 N2O4(g)的平衡常数K= 。
N2O4(g)的平衡常数K= 。(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因 。
(5)已知在相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度。常温下,若将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为:__________。
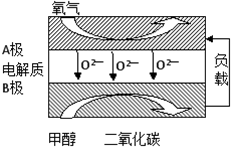
(6)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时,负极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(1)BC
(2)-1224.96
(3)13.3
(4)N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-
(5)c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
(6)N2H4+4OH--4e-=4H2O+N2 减少
(2)-1224.96
(3)13.3
(4)N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-
(5)c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
(6)N2H4+4OH--4e-=4H2O+N2 减少
(1)该反应是反应前后气体体积减小的、放热的可逆反应,要使该反应向正反应方向移动,可改变反应物的浓度、体系的压强、温度等。
减小N02的浓度,平衡向逆反应方向移动,NO2的转化率降低,故A错误;
降低温度,平衡向正反应方向移动,NO2的转化率提高,故B正确;
增加NO2的浓度,相当于体系压强增大,利于反应向正反应方向移动,NO2的转化率提高,故C正确;
升高温度,平衡向逆反应方向移动,NO2的转化率降低,故D错误。
(2)1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量,则2molN2O4(l)的质量为2mol×32g/mol=64g,放出热量为19.14kJ×64=1224.96KJ的热量。
(3)平衡时,c(NO2)=0.030 0mol?L-1、c(N2O4)=0.012 0mol?L-1
反应2NO2(g) N2O4(g)的平衡常数
N2O4(g)的平衡常数
k= c(N2O4)/c2(NO2)=0.012 0/0.030 02==13.3。
(4)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-。
(5)将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,得到等量的N2H4?H2O、N2H5C1,由相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度,则c(N2H5+)>c(Cl-),又溶液显碱性,即c(OH-)>c(H+),电离、水解的程度都不大,所以c(N2H5+)>c(Cl-)>c(OH-)>c(H+)。
(6)燃料电池中负极上投放的是燃料肼,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2;反应过程中生成水导致溶液中氢氧根离子浓度减小,所以溶液的pH值变小。
减小N02的浓度,平衡向逆反应方向移动,NO2的转化率降低,故A错误;
降低温度,平衡向正反应方向移动,NO2的转化率提高,故B正确;
增加NO2的浓度,相当于体系压强增大,利于反应向正反应方向移动,NO2的转化率提高,故C正确;
升高温度,平衡向逆反应方向移动,NO2的转化率降低,故D错误。
(2)1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量,则2molN2O4(l)的质量为2mol×32g/mol=64g,放出热量为19.14kJ×64=1224.96KJ的热量。
(3)平衡时,c(NO2)=0.030 0mol?L-1、c(N2O4)=0.012 0mol?L-1
反应2NO2(g)
 N2O4(g)的平衡常数
N2O4(g)的平衡常数k= c(N2O4)/c2(NO2)=0.012 0/0.030 02==13.3。
(4)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O=N2H5++OH-;N2H5++H2O=N2H62++OH-。
(5)将0.2mol/L N2H4?H2O溶液与0.1mol/L HCl溶液等体积混合,得到等量的N2H4?H2O、N2H5C1,由相同条件下N2H4?H2O的电离程度大于N2H5C1的水解程度,则c(N2H5+)>c(Cl-),又溶液显碱性,即c(OH-)>c(H+),电离、水解的程度都不大,所以c(N2H5+)>c(Cl-)>c(OH-)>c(H+)。
(6)燃料电池中负极上投放的是燃料肼,负极上肼失电子和氢氧根离子反应生成水和氮气,电极反应式为:N2H4+4OH--4e-=4H2O+N2;反应过程中生成水导致溶液中氢氧根离子浓度减小,所以溶液的pH值变小。

练习册系列答案
相关题目
 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是 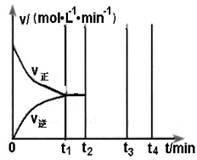
 2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。
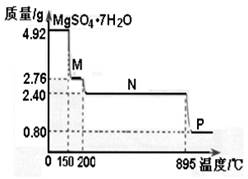
2C(g)+xD(g),经过5 min后达到化学平衡,此时生成2 molC。又知在此时D的平均速率为0.15 mol·L-1·min-1。 CH3OH(g) △H= 。
CH3OH(g) △H= 。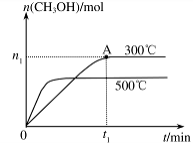
 2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表: 2SO3的说法中正确的是
2SO3的说法中正确的是 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
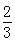 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )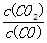
 2NH3 。下列有关说法正确的是:
2NH3 。下列有关说法正确的是: