题目内容
17.实验测得BH3为平面三角形(键角均为120°),NH3为三角锥形(键角为107°18′),已知电子数相同的微粒具有相似的结构.由此推断:①甲基,②甲基碳正离子(CH3+),③甲基碳负离子(CH3-)的键角相对大小顺序为( )| A. | ②>①>③ | B. | ①>②>③ | C. | ③>①>② | D. | ①═②═③ |
分析 根据价层电子对互斥理论确定中心原子杂化方式和微粒空间构型来判断.
解答 解:①甲基(-CH3)含有3个σ键,1个孤电子,碳原子杂化方式是sp3,为三角锥形结构,由于孤电子的影响小于孤电子对,故键角大于107°18′小于120°;
②碳正离子(CH3+)含有3个σ键,没有孤电子对,碳原子杂化方式是sp2,为平面三角形结构,键角为120°;
③碳负离子(CH3-)含有3个σ键,1对孤电子对,碳原子杂化方式是sp3,为三角锥形结构,键角为107°18′,
故选A.
点评 本题考查了微粒空间构型及原子杂化方式,根据价层电子对互斥理论来分析解答即可,难点的孤电子对个数的计算方法,为常考查点,要熟练掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.已知葡萄糖的燃烧热△H=-2804kJ/mol,当它氧化生成1g水时放出的热量是( )
| A. | 26.0kJ | B. | 155.8kJ | C. | 51.9kJ | D. | 467.3kJ |
8.自来水常用Cl2消毒,某学生用这种自来水去配制下列物质的溶液,不会产生明显的药品变质问题的是( )
| A. | AgNO3 | B. | Ca(OH)2 | C. | Na2SO3 | D. | AlCl3 |
5.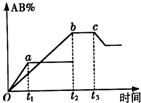 密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
 密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )
密闭容器中反应:A2+B2?2AB,产物AB的生成情况如图所示,a为500℃,b为300℃时的情况,c为300℃从时间t3开始向容器中加压的情况,下列叙述正确的是( )| A. | A2、B2、AB均为气体,正反应放热 | |
| B. | AB为气体,A2、B2中最少有一种为非气体,正反应吸热 | |
| C. | AB为气体,A2、B2中最少有一种为非气体,正反应放热 | |
| D. | AB为固体,A2、B2中最少有一种为非气体,正反应吸热 |
2.硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3•ySO3•zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
| A. | Fe2O3•2SO3•7H2O | B. | 4Fe2O3•10SO3•25H2O | ||
| C. | 3Fe2O3•6SO3•20H2O | D. | 2Fe2O3•5SO3•17H2O |
9.由乙酸、乙二酸和甲酸组成的混合物x g,经完全燃烧生成CO2 4.48L(标准状况),完全中和同质量的混合物需80mL2mol/L NaOH溶液,则x的数值可能是( )
| A. | 5.40g | B. | 6.25g | C. | 7.85g | D. | 8.10g |
6.Cu(NO3)2是制备Ca-Zn-Al系列催化剂的重要原料,制取Cu(NO3)2现有三种方案
①Cu与稀硝酸反应制取:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3═Cu(NO3)2+2NO↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O
下列说法正确的是( )
①Cu与稀硝酸反应制取:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3═Cu(NO3)2+2NO↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2═2Cu(NO3)2+2H2O
下列说法正确的是( )
| A. | 制取相同量的Cu(NO3)2 需硝酸的量③最多 | |
| B. | 制取相同量的Cu(NO3)2,①产生的有毒气体的物质的量比②多 | |
| C. | 从环保角度考虑,应选用方案③ | |
| D. | 三种方案的反应都可以在铁制容器中进行 |
 .
.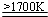 2AlN+3H2.
2AlN+3H2.