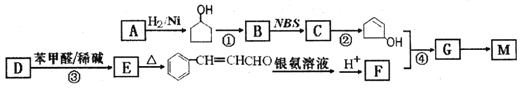
题目内容
【题目】镁的化合物在化工生产和药物合成上有重要用途。某兴趣小组以一种工业废渣(主要成分为MgCO3、MgSiO3和少量Fe的氧化物)为原料制备MgCO3·3H2O。实验过程如下:

(1)废渣的成分为_________(填化学式),过滤装置在使用一段时间后需用NaOH溶液清洗,用化学方程式表示其清洗原理_____________________。
(2)加入H2O2的目的是__________________,一段时间后,溶液中有气泡出现并放热,则产生气泡的原因是____________。
(3)萃取分液中要用到分液漏斗,分液漏斗在使用前须洗干净并________________。萃取分液的目的是____________。(填序号)
A、除去水溶液中的铁离子
B、增加镁离子在水中的溶解性
C、富集铁元素,可以回收利用
(4)萃取后得到的水溶液制备MgCO3·3H2O的实验操作:边搅拌边向溶液中滴加Na2CO3溶液至有大量沉淀生成,静置,________,确定沉淀完全后,过滤、____________,得到MgCO3·3H2O。
【答案】 H2SiO3 H2SiO3+2NaOH=Na2SiO3+2H2O 将Fe2+氧化成Fe3+ Fe3+催化H2O2分解 检漏 A C 向上层清液中滴加Na2CO3溶液,若无沉淀生成 用水洗涤固体2-3次、在50℃下干燥
【解析】试题分析:由已知及流程图,向废渣中加入40%H2SO4酸溶,MgCO3和少量Fe的氧化物溶解,MgSiO3与硫酸反应生成H2SiO3沉淀;过滤后向所得溶液中加30%H2O2氧化,使Fe元素存在形式变为Fe3+,然后加入有机萃取剂分离出去;最后溶液经过一系列处理,得到MgCO3·3H2O。
解析:(1)因为H2SO4+MgSiO3=MgSO4+H2SiO3↓,所以酸溶后所得滤渣为H2SiO3;过滤装置在使用一段时间后,会有硅酸沉积,需用NaOH溶液清洗,生成可溶性的Na2SiO3。故答案为:H2SiO3 ; H2SiO3+2NaOH=Na2SiO3+2H2O。
(2)加入H2O2是为了将Fe2+氧化为Fe3+,从而在后续步骤从溶液中分离出去;因为Fe3+能够对H2O2的分解起催化作用,所以一段时间后,溶液中有气泡出现并放热。故答案为:将Fe2+氧化成Fe3+ ;Fe3+催化H2O2分解。
(3)使用分液漏斗前必须进行检漏;通过萃取分液既可以除去水溶液中的Fe3+,又可以富集铁元素,回收利用。故答案为:检漏;AC。
(4)向萃取后的水溶液中滴加Na2CO3溶液会生成MgCO3,至有大量沉淀生成,静置,取上层清液滴加Na2CO3溶液,若无沉淀生成 ,则说明MgCO3已沉淀完全,过滤、用蒸馏水洗剂沉淀2~3次、低温干燥,就能得到MgCO3·3H2O。故答案为:向上层清液中滴加Na2CO3溶液,若无沉淀生成; 用水洗涤固体2-3次、在50℃下干燥。
点晴:分离提纯型探究实验评价题一般以物质的制备、分离、提纯为基础,考查基本的实验原理、实验方法和实验基本操作。在解题过程中需要注意题目所提供的信息,特别是新物质的制备过程中,有一些特殊的性质(如易水解、熔沸点等)。工艺流程题与各个知识模块的结合点较多,因此在分析工业生产工艺流程题时,应将流程路线、试题设问和理论知识有机结合起来。解题时首先要明确原料和产品(包括副产品),即箭头进出方向,其次依据流程图分析反应原理,紧扣信息,搞清流程中每一步发生了什么反应,弄清有关反应原理,明确目的(如沉淀反应、除杂、分离等),最后联系储存的知识,有效利用信息,准确答题。