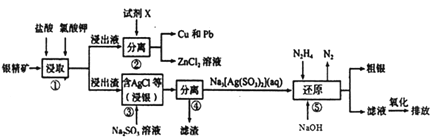
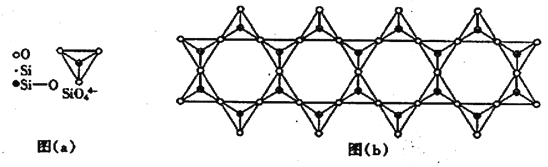
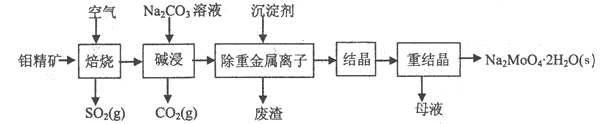
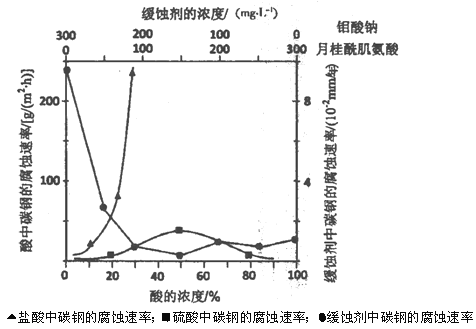
题目内容
【题目】下列各组中化合物的性质比较,正确的是( )
A.酸性:HClO>HBrO4>HIO4
B.碱性:Al(OH)3>Mg(OH)2>NaOH
C.稳定性:PH3>H2S>HCl
D.非金属性:F>O>S
【答案】D
【解析】解:A.非金属性Cl>Br>I,则酸性:HClO4>HBrO4>HIO4 , 而HClO为酸性很弱的酸,故A错误; B.金属性Na>Mg>Al,碱性:Al(OH)3<Mg(OH)2<NaOH,故B错误;
C.非金属性Cl>S>P,对应氢化物稳定性:PH3<H2S<HCl,故C错误;
D.同周期从左向右非金属性增强,同主族从上到下非金属性减弱,则非金属性:F>O>S,故D正确;
故选D.

练习册系列答案
相关题目
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HClO |
|
|
电离平衡常数 |
|
|
|
|
(1)室温下![]()
![]()
![]()
![]()
![]() 溶液的pH由大到小的关系为______.
溶液的pH由大到小的关系为______.
(2)浓度均为![]() 的
的![]() 和
和![]() 的混合溶液中,
的混合溶液中, ![]() 、
、![]() 、
、![]() 、
、![]() 浓度从大到小的顺序为______.
浓度从大到小的顺序为______.
(3)少量![]() 通入到过量的NaClO溶液中发生反应的离子方程式______.
通入到过量的NaClO溶液中发生反应的离子方程式______.
(4)常温下, ![]() 的HCOOH溶液与
的HCOOH溶液与![]() 的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.
的NaOH溶液等体积混合后,溶液中离子浓度由大到小的顺序为______.