题目内容
【题目】下列有关含碳微粒的说法,按要求填空:
(1)同温度,同浓度的Na2CO3溶液的碱性_________ NaHCO3溶液的碱性(填“大于”、“小于”或“等于”),请设计一个较简便的实验证明___________。
(2)在25 ℃时,在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液20 mL,溶液中含碳微粒的物质的量随溶液pH的变化如图所示。
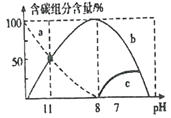
①HC1溶液滴加到一半时,溶液呈___________(填“酸性”、“碱性”或“中性”),理由是____________________(用主要的离子方程式表示)。
②关于图像下列说法正确的是_________________。
A、0.1 mol/L Na2CO3溶液中:c(Na+) + c(H+) = c(OH-) + 2c(CO32-) + c(HCO3-)
B、b曲线代表CO32-
C、pH=11时,c(HCO3-) > c(Cl-)
D、pH=11 时,c(Na+) + c(H+) = 3c(CO32-) + c(OH-)
E、在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
(3)草酸(H2C2O4)溶液具有还原性,将酸性KMnO4溶液滴入草酸溶液中,会产生气泡,且紫红色褪去,写出该反应的离子方程式________________。
【答案】大于 同温、同浓度下测量两者溶液pH值,Na2CO3大 碱性 HCO3-+H2O ![]() H2CO3+OH- ACD 2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O
H2CO3+OH- ACD 2MnO4-+5H2C2O4+6H+ =2Mn2++10CO2↑+8H2O
【解析】
(1)根据碳酸钠和碳酸氢钠的水解程度分析判断两溶液的碱性强弱;根据溶液的酸碱性和pH的关系分析解答;
(2)在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,碳酸钠首先与盐酸反应生成碳酸氢钠和氯化钠,Na2CO3 + HCl = NaHCO3 +NaCl,然后碳酸氢钠继续反应生成二氧化碳和水、氯化钠,NaHCO3 + HCl=NaCl+H2O+CO2↑;根据图像可知,a为CO32-,b为HCO3-,c为CO2,据此分析解答;
(3)草酸(H2C2O4)溶液具有还原性,酸性KMnO4溶液具有强氧化性,根据氧化还原反应方程式的配平原则书写并配平方程式。
(1)碳酸根离子的水解程度大于碳酸氢根离子,同温度,同浓度的Na2CO3溶液的碱性大于NaHCO3溶液的碱性;可以根据等物质的量浓度的Na2CO3溶液和NaHCO3溶液的pH的大小判断溶液的碱性强弱,故答案为:大于;同温、同浓度下测量两者溶液pH值,Na2CO3大于NaHCO3;
(2)在10 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液,碳酸钠首先与盐酸反应生成碳酸氢钠和氯化钠,Na2CO3 + HCl = NaHCO3 +NaCl,然后碳酸氢钠继续反应生成二氧化碳和水、氯化钠,NaHCO3 + HCl=NaCl+H2O+CO2↑;根据图像可知,a为CO32-,b为HCO3-,c为CO2。
①根据上述分析,HC1溶液滴加到一半时,恰好生成碳酸氢钠,碳酸氢钠水解,溶液呈碱性,水解的离子方程式为HCO3-+H2O ![]() H2CO3+OH-,故答案为:碱性;HCO3-+H2O
H2CO3+OH-,故答案为:碱性;HCO3-+H2O ![]() H2CO3+OH-;
H2CO3+OH-;
②A、任何电解质溶液中都存在电荷守恒,根据电荷守恒得:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故A正确;B、根据上述分析,b曲线代表HCO3-,故B错误;C、根据图像,pH=11时,溶液中含有等物质的量浓度的Na2CO3和NaHCO3,此时溶液显碱性,以碳酸钠的水解为主,根据方程式生成的氯化钠少于溶液中的碳酸氢钠,因此c(HCO3-) > c(Cl-),故C正确;D、根据图像,pH=11时,溶液中含有等物质的量浓度的Na2CO3和NaHCO3,溶液中c(HCO3-) = c(CO32-),结合电荷守恒:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),则c(Na+) + c(H+) = 3c(CO32-) + c(OH-),故D正确;E、根据图像,在同一溶液中,H2CO3、HCO3-、CO32-不能大量共存,如pH=7时,几乎没有CO32-,故E错误;正确的有ACD,故答案为:ACD;
(3)草酸(H2C2O4)溶液具有还原性,酸性KMnO4溶液具有强氧化性,向盛有草酸饱和溶液的试管中滴入几滴酸性KMnO4溶液,振荡,溶液的紫红色褪去,说明草酸被酸性高锰酸钾氧化,根据氧化还原反应方程式的配平原则:得失电子守恒、质量守恒和电荷守恒配平该反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为: 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。

【题目】某温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g)发生反应H2(g) + CO2(g) ![]() H2O(g) + CO(g),其起始浓度如表所示,已知平衡时甲中H2的转化率为60%。下列判断正确的是
H2O(g) + CO(g),其起始浓度如表所示,已知平衡时甲中H2的转化率为60%。下列判断正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(H2)[mol/L] | 0.010 | 0.020 | 0.020 |
c(CO2)[mol/L] | 0.010 | 0.010 | 0.020 |
A. 刚开始反应时,乙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,乙中H2的转化率大于60%
C. 平衡时,丙中c(CO) = 0.008 mol/L
D. 该温度下,平衡常数K=9/4





