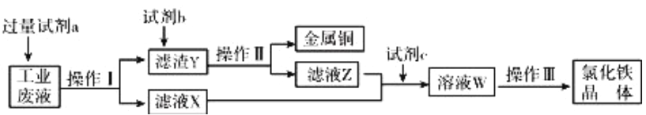
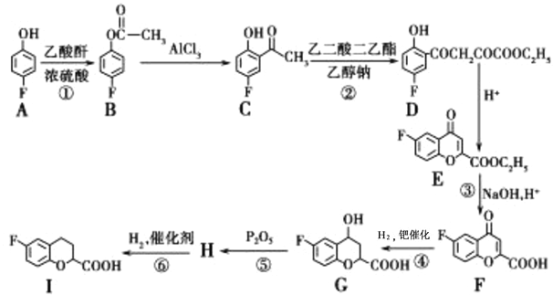
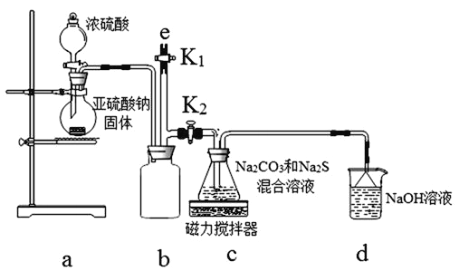
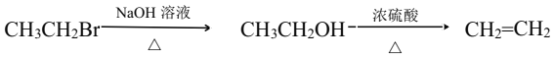题目内容
【题目】一块表面被氧化的钠,投入足量水中充分反应,放出3.36L(标准状况)的气体,该气体在电火花下刚好完全反应;测得反应后溶液的体积为200mL,此溶液与100mL6mol/L的盐酸恰好完全中和。试计算(简要写出计算过程):
(1)反应所得NaOH溶液的物质的量浓度是多少______?
(2)该表面被氧化的钠各成分的质量是多少g______?
【答案】3mol/L m(Na) =4.6g 、m(Na2O)=6.2g 、m(Na2O2)=7.8g
【解析】
表面已氧化变质的金属Na投入水反应生成的气体在电火花下刚好完全反应,说明生成的气体为氢气和氧气的混合物,因此该固体中含有钠、过氧化钠,根据与盐酸反应的氢氧化钠的量分析判断有无氧化钠,再结合反应的方程式分析计算。
(1)表面已氧化变质的金属Na投入水,无论是钠、氧化钠还是过氧化钠与水反应均生成氢氧化钠,因此所得溶液为氢氧化钠溶液,所得溶液200mL与100mL6mol/L盐酸恰好反应,最终溶质为NaCl,所得200mL溶液中n(Na+)=n(Cl-)=6mol/L×0.1L=0.6mol, 由Na元素守恒,溶液中氢氧化钠的物质的量为0.6mol,NaOH溶液的物质的量浓度=![]() =3mol/L,答:反应所得NaOH溶液的物质的量浓度是3mol/L;
=3mol/L,答:反应所得NaOH溶液的物质的量浓度是3mol/L;
(2)收集到气体3.36L,气体的物质的量n=![]() =0.15mol,该气体在电火花下刚好完全反应,说明生成的气体为氢气和氧气的混合气体,且n(H2)∶n(O2)=2∶1,即n(H2)=0.1mol,n(O2)=0.05mol,根据2Na+2H2O=2NaOH+H2↑,需要钠0.2mol,质量为0.2mol×23g/mol=4.6g,根据2Na2O2 + 2H2O = 4NaOH + O2 ↑,则表面的过氧化钠为0.1mol,质量=0.1mol×78g/mol=7.8g,根据钠元素守恒,表面生成的氧化钠的物质的量=
=0.15mol,该气体在电火花下刚好完全反应,说明生成的气体为氢气和氧气的混合气体,且n(H2)∶n(O2)=2∶1,即n(H2)=0.1mol,n(O2)=0.05mol,根据2Na+2H2O=2NaOH+H2↑,需要钠0.2mol,质量为0.2mol×23g/mol=4.6g,根据2Na2O2 + 2H2O = 4NaOH + O2 ↑,则表面的过氧化钠为0.1mol,质量=0.1mol×78g/mol=7.8g,根据钠元素守恒,表面生成的氧化钠的物质的量=![]() =0.1mol,质量为0.1mol×62g/mol=6.2g,答:表面被氧化的钠各成分的质量分别为m(Na) =4.6g 、m(Na2O)=6.2g 、m(Na2O2)=7.8g。
=0.1mol,质量为0.1mol×62g/mol=6.2g,答:表面被氧化的钠各成分的质量分别为m(Na) =4.6g 、m(Na2O)=6.2g 、m(Na2O2)=7.8g。