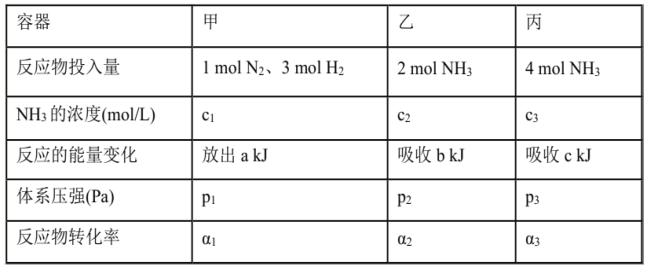
题目内容
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:
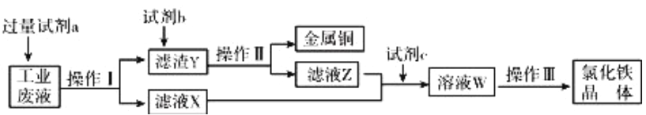
则下列说法正确的是( )
A. 试剂a是铁、试剂b是稀硫酸
B. 操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C. 试剂c是氯气,相应的反应为:2Fe2++Cl2=2Cl-+2Fe3+
D. 用酸性KMn04溶液可检验溶液W中是否还有Fe2+
【答案】C
【解析】
从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜,工业废水中加入试剂a为过量的铁,操作Ⅰ为过滤,得到滤渣为Fe、Cu,滤液为氯化亚铁溶液,滤渣Y中加入试剂b为盐酸溶解过量的铁生成氯化亚铁溶液,铜不溶,操作Ⅱ过滤得到铜和滤液Z为氯化亚铁溶液,滤液Z和X合并加入氧化剂(试剂c),氧化氯化亚铁溶液为氯化铁溶液,氯化铁溶液经蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到氯化铁晶体,据此答题。
A.由最终得到FeCl3及其流程图可知,b为盐酸,若为硫酸会引入硫酸根杂质离子,故A错误;
B.上述分析可知,操作Ⅰ、Ⅱ是过滤,操作Ⅲ是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,蒸发浓缩与过滤所用仪器不同,故B错误;
C.滤液X,滤液Z中均含有FeCl2,c为氯气,氧化亚铁离子为铁离子,反应为:2Fe2++Cl2═2Cl-+2Fe3+,故C正确;
D.亚铁离子、氯离子都可以被高锰酸钾溶液氧化,用酸性KMnO4溶液不能检验溶液W中是否还有Fe2+,故D错误。
故选C。

练习册系列答案
相关题目