题目内容
水的电离过程为:H2O H++OH-,在不同温度下其平衡常数为Kw(25 ℃)=1.0×10-14,Kw(35 ℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为Kw(25 ℃)=1.0×10-14,Kw(35 ℃)=2.1×10-14。则下列叙述正确的是
| A.c(H+)随着温度升高而降低 | B.在35℃时,c(H+)>c(OH-) |
| C.蒸馏水中通HCl, Kw增大 | D.水的电离为吸热过程 |
D
解析试题分析:A.由水在不同温度下的电离平衡常数可知:升高温度,促进了水的电离,c(H+)随着温度升高而增大。错误。B.水的电离过程为:H2O H++OH-,升高温度,水的电离平衡正向移动,但是仍然是c(H+)=c(OH-)。错误。C.蒸馏水中通HCl,c(H+)增大,水的电离平衡逆向移动,但是对这个溶液来说,c(H+)·c(OH-)=Kw。温度不变,Kw就不变。错误。D.水是弱电解质,任何弱电解质的电离过程都是断裂化学键的过程,所以都需要吸收能力。因此水的电离为吸热过程。正确。
H++OH-,升高温度,水的电离平衡正向移动,但是仍然是c(H+)=c(OH-)。错误。C.蒸馏水中通HCl,c(H+)增大,水的电离平衡逆向移动,但是对这个溶液来说,c(H+)·c(OH-)=Kw。温度不变,Kw就不变。错误。D.水是弱电解质,任何弱电解质的电离过程都是断裂化学键的过程,所以都需要吸收能力。因此水的电离为吸热过程。正确。
考点:考查关于影响水的电离的知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
室温下向10 mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,c(H+)亦增大 |
| C.再加入10 m L pH="11" NaOH溶液,混合液pH=7 |
D.溶液中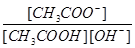 不变 不变 |
水中加入下列溶液对水的电离平衡不产生影响的是
| A.NaHSO4溶液 | B.KF溶液 | C.KAl(SO4)2溶液 | D.NaI溶液 |
实验①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀C中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+C1-(aq) Ag+(aq)+C1-(aq) |
| B.滤液b中不含Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
水是一种重要的资源,节约用水是“全民节约,共同行动”重要的一项。关于水的下列说法
正确的是
| A.水可以电离出离子,所以是强电解质 |
| B.水的离子积可表示KW=c(H+)·c(OH-) |
| C.常温下水中的c(H+)大于c(OH-) |
| D.升高温度,c(H+)增大,显弱酸性 |
下列有关碳酸钠或碳酸氢钠能发生水解的观点正确的是
A.在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-,通入CO2,平衡朝正反应方向移动 HCO3-+OH-,通入CO2,平衡朝正反应方向移动 |
| B.25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,只存在电离平衡,不存在水解平衡 |
| C.热的纯碱液去油污效果好,因为加热可使CO32-的水解程度增大,溶液碱性增强,去污力降低 |
| D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
下列说法正确的是
| A.将盐酸和醋酸钠溶液混合后溶液呈中性,溶液中c(Na+)=c(Cl-) |
| B.1 mol CH4分子中含有的共价键数目等于1 mol Na2O2固体中含有的离子总数 |
| C.80℃的纯水的pH大于25℃的纯水的pH |
| D.等体积、等物质的量浓度的NaCl溶液中离子总数大于NaClO溶液中离子总数 |
用1 mol·L-1NaOH溶液中和某浓度的硫酸溶液时,其pH和所加NaOH溶液的体积关系如图所示,原硫酸溶液的物质的量浓度和反应后溶液的总体积分别是
| A.0.5 mol·L-1 100 mL | B.0.5 mol·L-180 mL |
| C.1 mol·L-160 mL | D.1 mol·L-180 Ml |
下列事实可证明一水合氨是弱电解质的是
| A.0.1mol/L的氨水可使酚酞试液变红 |
| B.0.1mol/L的氯化铵溶液的pH约为5 |
| C.在相同条件下,氨水溶液的导电性比强碱溶液弱 |
| D.铵盐受热易分解 |