题目内容
【题目】设NA为阿伏加德罗常数的值, 下列说法正确的是( )
A. 常温下,将5. 6g铁片投入足量浓硝酸中生成6. 72L NO2气体
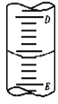
B. 1mol苯乙烯(![]() )分子中含有碳碳双键的个数为4 NA
)分子中含有碳碳双键的个数为4 NA
C. 标准状况下,11.2L的二氯甲烷所含的分子数为0. 5NA
D. 常温常压下,28g由C2H4和C3H6组成的混合物中,H原子的数目为4NA
【答案】D
【解析】
A. 常温下,铁片遇浓硝酸会发生钝化,只有表面部分参与反应,无法计算NO2气体的体积,A项错误;
B. 1mol苯乙烯(![]() )分子中含有碳碳双键的个数为NA,苯环不含碳碳双键,B项错误;
)分子中含有碳碳双键的个数为NA,苯环不含碳碳双键,B项错误;
C. 标况下,二氯甲烷为液体,不能使用气体摩尔体积,C项错误;
D. 由C2H4和C3H6组成的混合气体的平均分子式是CH2,所以28g的该混合气体中C的物质的量是![]() =2mol,所以H原子的数目为4NA,D项正确;
=2mol,所以H原子的数目为4NA,D项正确;
答案选D。

【题目】将足量的新制氯水分别滴加到下列溶液或滤纸上,对所观察到的现象描述合理的一组是
AgNO3溶液 | 蓝色石蕊试纸 | Na2CO3溶液 | |
A | 产生沉淀 | 变红后无现象 | 有气泡 |
B | 无明显现象 | 变红后无现象 | 产生沉淀 |
C | 产生沉淀 | 先变红后褪色 | 有气泡 |
D | 产生沉淀 | 先变红后褪色 | 产生沉淀 |
A.AB.BC.CD.D
【题目】Ⅰ.实验室常用以下几种方法制取氯气。
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式:________________________________________________________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式:________________________________________________________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数的测定。
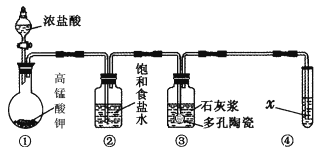
(1) 装置③中发生反应的化学方程式为____________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是________________________________________________________________________。
(2)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.100 0 mol·L-1KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为
3ClO-+I-===3Cl-+IO
IO+5I-+3H2O===6OH-+3I2
实验测得数据如下表所示。
滴定次数 | 1 | 2 | 3 |
KI溶液体积/mL | 19.98 | 20.02 | 20.00 |
该漂白粉中有效成分的质量分数为________;若滴定过程中未充分振荡溶液,局部变浅蓝色时就停止滴定,则测定结果将________(填“偏高”“偏低”或“无影响”)。