题目内容
【题目】发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) ΔH1=-0.92 kJ·mol-1 (2)O2(g)=O2(l) ΔH2=-6.84 kJ·mol-1
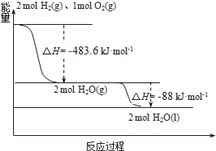
下列说法正确的是
A. H2(g)与O2(g)反应生成H2O(g)放热483.6kJmol﹣1
B. 氢气的燃烧热为△H=﹣241.8 kJmol﹣1
C. 火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l) = 2H2O(g) ΔH=-474.92kJ·mol-1
D. H2O(g) =H2O(l) ΔH=﹣88kJ·mol-1
【答案】C
【解析】A、每2molH2(g)与O2(g)反应生成2molH2O(g)放热483.6kJmol﹣1,故A正确;B、氢气的燃烧热为△H=﹣(483.6+88)/2 kJomol﹣1=-285.8 kJomol﹣1,故B错误;C、火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l) = 2H2O(g) ΔH=-(483.6-2×0.92-6.84)=-474.92kJ·mol-1,故C正确;D、 H2O(g) =H2O(l) ΔH=﹣88/2kJ·mol-1=﹣44kJ·mol-1,故D错误;故选C。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中部分元素在周期表中的位置如图所示。一个WX2分子中含有22个电子,Y的质子数是X、Z的核电荷数之和的—半。下列说法正确的是
W | X | |
Z |
A. 非金属性:W < Z
B. 简单离子的半径:X2- < Y2+
C. 沸点:H2X < H2Z
D. WX2的电子式为:![]()
