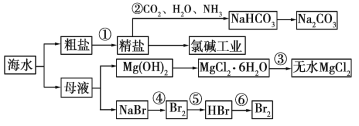
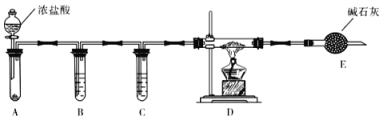
题目内容
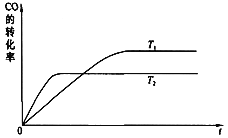
【题目】在恒压密闭容器中,充入一定量的H2和CO2 发生如下可逆反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH <0,实验测得反应物在不同温度下,反应体系中CO2的平衡转化率与压强的关系曲线如图所示。
CH3OH(g)+H2O(g)ΔH <0,实验测得反应物在不同温度下,反应体系中CO2的平衡转化率与压强的关系曲线如图所示。

(1)该反应的ΔS______0(填>或<),该反应在_______(填“低温”或“高温”)条件下利于自发进行;
(2)比较T1与T2的大小关系:T1__T2(填“<”、“=”或“>”),理由是_______。
(3)在T1和P6的条件下,往密闭容器中充入3 mol H2和1 mol CO2,该反应在第5 min时达到平衡,此时容器的体积为1.8 L;则该反应在此温度下的平衡常数为____;若温度不变,压强恒定在P8的条件下重新达到平衡时,容器的体积变为_____L。
【答案】<低温<反应Ⅲ为放热反应,温度降低,反应正向移动,所以T1<T24/27或0.1488/15或0.533
【解析】
(1)根据方程式可知正反应是体积减小的放热的可逆反应,因此该反应的ΔS<0;由于ΔG=ΔH-TΔS<0时反应自发进行,所以该反应在低温下自发进行;
(2)反应放热反应,温度降低,反应正向移动,二氧化碳的转化率升高,所以T1<T2;
(3)在T1和P6的条件下平衡时二氧化碳的转化率是40%,则根据方程式可知
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始量:1mol 3mol 0 0
变化量:0.4mol 1.2mol 0.4mol 0.4mol
平衡量:0.6mol 1.8mol 0.4mol 0.4mol
达到平衡时容器的体积为1.8 L,所以CO2、H2、CH3OH、H2O(g)的浓度分别是(mol·L-1)1/3、1、2/9、2/9,所以平衡常数K=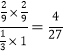 ;若温度不变,压强恒定在P8的条件下重新达到平衡时,二氧化碳的转化率是60%。则
;若温度不变,压强恒定在P8的条件下重新达到平衡时,二氧化碳的转化率是60%。则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
初始量:1mol 3mol 0 0
变化量:0.6mol 1.8mol 0.6mol 0.6mol
平衡量:0.4mol 1.2mol 0.6mol 0.6mol
温度不变,K不变,则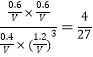
解得V=8/15 L。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】下表是有机物 A、B、C、D 的有关信息:
A | ①无色无味、难溶于水; ②最简单的有机化合物 | B | ①能使溴的四氯化碳溶液褪色; ②比例模型为: ③能与水在一定条件下反应生成 D |
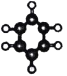
C | ①由 C、H 两种元素组成; ②球棍模型为: | D | ①能与钠反应,但不能与 NaOH 溶液反应; ②在催化剂条件下能被空气中的氧气氧化为 E |
根据表中信息回答下列问题:
(1)写出B 的结构式_____;D 的官能团名称是_____。
(2)B 能使溴的四氯化碳溶液褪色,反应后生成物的名称_____。
(3)B→D 的化学反应类型为_____。
(4)D 催化氧化生成E 的化学方程式为_____。
(5)C 的分子式是_____,写出在浓硫酸作用下,C 在 50 ~60℃与浓硝酸发生反应的化学方程式:_____。
(6)与A 互为同系物的物质均符合通式 CnH2n+2,当 n=5 时,该有机物有_____种同分异构体, 其中碳链最短的同分异构体的结构简式是_____。