题目内容
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。回答下列问题:
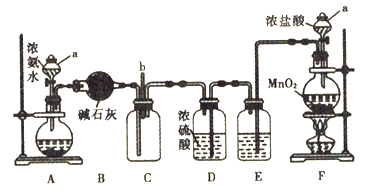
(1)仪器a的名称为______________。装置A的圆底烧瓶中盛放的固体物质可选用_______(填序号)
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置B、D的作用均为_____________________。从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有_____________溶液的洗气瓶。
(3)装置F的圆底烧瓶中发生反应的离子方程式为____________________________。装置E的作用是除去Cl2中的HCl,洗气瓶中盛 放的试剂为_________________________。
(4)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为N2。该反应的化学方程式为___________________________________________________。
【答案】 分液漏斗 b 除去水蒸气或干燥 NaOH MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O 饱和食盐水 8NH3+3Cl2===6NH4Cl+N2
Mn2++Cl2↑+2H2O 饱和食盐水 8NH3+3Cl2===6NH4Cl+N2
【解析】(1). 据图可知,仪器a是分液漏斗, 氢氧化钠、生石灰或者碱石灰具有吸水性,利用氢氧化钠、生石灰或者碱石灰与浓氨水可快速制取氨气,所以选b,故答案为:分液漏斗;b;
(2). 制取的氨气和氯气中均混有水蒸气,装置B中盛装的碱石灰、D中盛装的浓硫酸均可以除去水蒸气,起干燥气体的作用,氯气有毒,能够与氢氧化钠溶液反应,可以用氢氧化钠溶液吸收尾气中的氯气,故答案为:除去水蒸气或干燥;NaOH;
(3). 二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,反应的离子方程式:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O,浓盐酸易挥发,制得的氯气中含有HCl杂质,通过盛有饱和食盐水的洗气瓶可以除去HCl杂质,所以E中盛放的是饱和食盐水,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,浓盐酸易挥发,制得的氯气中含有HCl杂质,通过盛有饱和食盐水的洗气瓶可以除去HCl杂质,所以E中盛放的是饱和食盐水,故答案为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;饱和食盐水;
Mn2++Cl2↑+2H2O;饱和食盐水;
(4). 反应过程中,装置C的集气瓶中有大量白烟产生,说明生成的产物有氯化铵,另一种产物为N2,根据得失电子守恒和原子守恒,该反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2,故答案为:8NH3+3Cl2===6NH4Cl+N2。

【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、Fe2O3、SiO2。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:

(1)试剂A的化学式为_____________;固体b的化学式为______________。
(2)生成气体X的化学方程式为_________________________________。
(3)已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH如表所示
Fe3+ | Cu2+ | Fe2+ | |
开始沉淀的pH | 2.7 | 5.1 | 8.1 |
沉淀完全的pH | 3.0 | 6.7 | 9.6 |
加入足量双氧水的目的是___________________________________(用离子方程式表示)。设计实验方案证明加入的双氧水已足量_____________________________________(实验方案包括试剂、现象和结论)。
(4)① 试剂B的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂B可选用__________________。
A.NaOH溶液 B. Cu C.CuO D.Cu2(OH)2CO3
② 为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为________________。
(5)操作Ⅱ包括__________________、洗涤、干燥。