题目内容
工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g) CH3OH(g) ΔH
CH3OH(g) ΔH
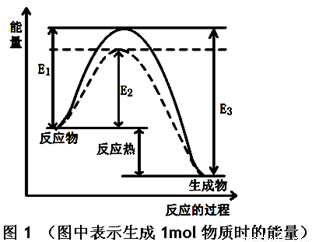
(1)根据图1请写出合成甲醇的热化学方程式
(热量用E1、E2或E3表示)。
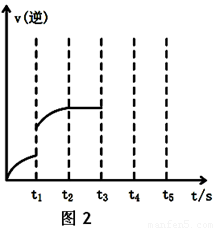
(2)该反应的逆反应速率随时间变化的关系如上图2。t1时改变了某种条件,改变的条件可能是 。
(3)判断反应达到平衡状态的依据是 (填字母序号,下同)。
A. 2v(H2)(逆) =v(CO)(正)
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
(4)在一定温度下,若将4a mol H2和2amol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为 。若此时再向该容器中投入a mol CO、2amol H2和amol CH3OH,判断平衡移动的方向是 (“正向移动”“逆向移动”或“不移动”);与原平衡相比,CO的物质的量浓度 (填“增大”、“不变”或“减小”)。
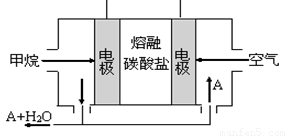
(5)某甲烷燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(见右图)。A物质的化学式是_________;该原电池的负极反应式可表示为 。
(1)CO(g) + 2H2(g)  CH3OH(g) ΔH=(E1-E3)或-(E3-E1)kJ•mol-1
CH3OH(g) ΔH=(E1-E3)或-(E3-E1)kJ•mol-1
(2分,没写物质状态不给分,不写单位不扣分)
(2)加压、等倍增加反应物和生成物、增加甲醇浓度、升高温度、使用催化剂等(2分)(任答一个合理答案给分。注:t1时刻不能确认是否平衡)
(3)CD(2分,见错不给分)
(4)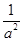 (2分)正向移动(2分)增大(1分)
(2分)正向移动(2分)增大(1分)
(5)A为CO2(2分)CH4+4CO32--8e- =5CO2+2H2O (2分)
【解析】
试题分析:(1)由图中可知,E1为断裂化学键所需要的能量,E3为形成化学键时所释放的能量,故每生成1mol甲醇的反应热为(E1—E3)KJ/mol。
(2)从图2曲线上可以看出,t1时刻前和t1时刻后,逆反应速率瞬间增大,可使反应速率增大的因素有增压、升温、加催化剂和增大物质浓度。
(3)判断反应是否达到平衡的依据是正逆反应速率相等和各物质浓度保持不变。在该反应中,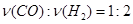 ,即
,即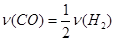 ,故A项不能说明反应已达到平衡状态;该反应在恒容容器中进行,反应物生成物都是气态,因此气体总质量和总体积一直不变,密度也一直不变,因此B项也不能说明反应达到平衡状态;当物质的质量以克为单位时,平均相对分子质量在数值上等于平均摩尔质量,
,故A项不能说明反应已达到平衡状态;该反应在恒容容器中进行,反应物生成物都是气态,因此气体总质量和总体积一直不变,密度也一直不变,因此B项也不能说明反应达到平衡状态;当物质的质量以克为单位时,平均相对分子质量在数值上等于平均摩尔质量,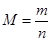 ,因为该反应是一个气体分子数目发生变化的反应,气体的物质的量也会发生变化,只有当反应达到平衡后,气体的物质的量才不再变化,即平均相对分子质量不再变化,因此C项可说明反应达到平衡状态;D项各物质浓度不再变化,反应达到平衡状态;反应达到平衡时,各物质的百分含量一定,物质间的比例一定,但数值不一定是1:2:1,E项不能说明反应达到平衡状态。
,因为该反应是一个气体分子数目发生变化的反应,气体的物质的量也会发生变化,只有当反应达到平衡后,气体的物质的量才不再变化,即平均相对分子质量不再变化,因此C项可说明反应达到平衡状态;D项各物质浓度不再变化,反应达到平衡状态;反应达到平衡时,各物质的百分含量一定,物质间的比例一定,但数值不一定是1:2:1,E项不能说明反应达到平衡状态。
(4)反应消耗CO的物质的量:2a×50%=amol。
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
初始量:2amol 4amol 0
变化量:amol 2amol amol
平衡量:amol 2amol amol
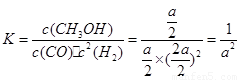
若再向该容器中投入a mol CO、2amol H2和amol CH3OH,相当于增大气体压强,平衡正向移动。与原平衡相比,因为增加了CO的量,但容器容积未变,所以CO的浓度增大。
(5)该电池为甲烷燃料电池,电池总反应为CH4+2O2=CO2+2H2O,电池的电解质为碳酸盐,且电解质溶液组成保持稳定,所以循环的物质应为CO2。燃料电池负极应通入燃料,故负极反应式为:CH4+4CO32--8e- =5CO2+2H2O。
考点:考查图像分析,热化学方程式书写,影响化学平衡因素,化学平衡状态的判断,化学平衡相关计算,燃料电池电极反应式书写。

 阅读快车系列答案
阅读快车系列答案 CH3OH(g)△H
CH3OH(g)△H