题目内容
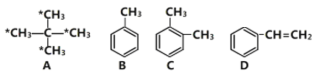
【题目】已知分解1mol H2O2放出热量98kJ,在含少量I- 的溶液中,H2O2分解的机理为①H2O2+I-→H2O+IO-(慢)、② H2O2+IO-→H2O+O2+I-(快)。下列有关该反应的说法不正确的是( )
A.过氧化氢分解快慢决定于反应慢的①
B.![]() 的分解速率与的
的分解速率与的![]() 浓度有关
浓度有关
C.该反应的催化剂是![]() ,而不是
,而不是![]()
D.由于催化剂的加入降低了反应的活化能,也改变了该反应的反应热
【答案】D
【解析】
A. 已知:①H2O2+I-→H2O+IO-,②H2O2+IO-→H2O+O2+I-,I- 是反应的催化剂,且为①的反应物之一,其浓度大小对反应有影响,化学反应速率的快慢由反应慢的反应决定,故A正确;
B. ②H2O2+IO-→H2O+O2+I- ,过氧化氢分解快慢决定于反应慢的①,![]() 的分解速率与
的分解速率与![]() 浓度有关,故B正确;
浓度有关,故B正确;
C. 已知:①H2O2+I-→H2O+IO-,②H2O2+IO-→H2O+O2+I-,I- 是反应的催化剂,IO-为催化剂的中间产物,故C正确;
D. 催化剂能降低反应的活化能,但不改变反应热,故D错误;
题目要求选择错误选项,故选D。

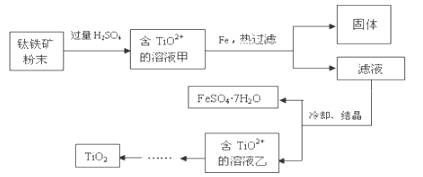
【题目】短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置_____________________,
E的原子结构示意图是________。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是____(填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式____。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为____,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为___________。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式___________________________________。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
物质 | Fe(OH)2 | Fe(OH)3 |
Ksp/25 ℃ | 2.0×10-16 | 4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于____mol·L-1。
【题目】某研究性学习小组探究醋酸的溶液情况,进行了如下实验。
(1)取一定量的冰醋酸配制250 mL 0.5000 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、___________和___________。
(2)该学习小组用pH试纸对上述0.5000 mol·L-1醋酸溶液进行了pH测定,请用文字描述pH试纸的使用方法______。
(3)用上述0.5000 mol·L-1的醋酸溶液再进行稀释,为测定稀释后醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对25.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 25.05 | 25.00 | 23.80 | 24.95 |
则该醋酸溶液的浓度为________________。
(4)实验(2)中,滴定过程中pH变化曲线如图所示(室温条件下)。

①滴定过程中,当滴加12.50mLNaOH时,所得混合溶液中离子浓度由大到小顺序为____________。
②当滴加25.00mLNaOH时,反应后测得混合溶液的pH=9。则混合溶液中:水的电离度是纯水的_____倍;
(5)在滴定过程中,下列操作会造成结果偏高的是________。
A.滴定终点时,滴定管尖嘴处有半滴悬而未落
B.读取NaOH溶液体积时,开始仰视读数,滴定结束后俯视读数
C.滴定过程中向锥形瓶中加水
D.滴定管水洗后未用标准液润洗