题目内容
8.有一铁的氧化物样品,用5mol/L的盐酸140mL恰好完全溶解,所得溶液还能与0.56L氯气(标准状况)反应,使Fe2+全部转化为Fe3+,则此氧化物为( )| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe5O7 |
分析 n(HCl)=0.14L×5mol/L=0.7mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,反应中HCl的H元素与氧化物中O元素全部结合生成H2O,反应后溶液成分为FeCl3,结合质量守恒计算.
解答 解:n(HCl)=0.14L×5mol/L=0.7mol,n(Cl2)=$\frac{0.56L}{22.4L/mol}$=0.025mol,
反应中HCl的H元素与氧化物中O元素全部结合生成H2O,则氧化物中n(O)=$\frac{1}{2}$×n(HCl)=$\frac{1}{2}$×0.7mol=0.35mol,
反应后溶液成分为FeCl3,
n(Cl-)=0.7mol+0.025mol×2=0.75mol,
则n(Fe)=0.75mol×$\frac{1}{3}$=0.25mol,
所以:n(Fe):n(O)=0.25mol:0.35mol=5:7,
该氧化物的化学式为Fe5O7,
故选D.
点评 本题考查氧化还原反应的计算,题目难度中等,注意反应中HCl的H元素与氧化物中O元素全部结合生成H2O,反应后溶液成分为FeCl3,为解答该题的关键,做题时注意体会.

练习册系列答案
相关题目
18.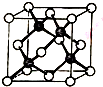 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )
 冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )
冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心球所示原子位于立方体的顶点或圆心,实心球所示原子位于立方体内)类似.下列有关冰晶胞说法合理的是( )| A. | 冰晶胞内水分子间以共价键结合 | |
| B. | 晶体冰与金刚石晶体硬度都很大 | |
| C. | 冰分子间的氢键具有方向性和饱和性,也是σ键一种 | |
| D. | 氢键存在导致冰晶胞与金刚石晶胞微料排列方式类似 |
19.下列叙述正确的是( )
| A. | 用分液漏斗分液时,上层液体经漏斗下口放出倒出 | |
| B. | 蒸发时,待混合物中的水分完全蒸干后,再停止加热 | |
| C. | 金属钠着火时,立即用水灭火 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 |
13.已知氢气的燃烧热为285.8kJ/mol,CO的燃烧热为282.8kJ/mol;现有H2和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量为710.0kJ,并生成液态水.下列说法正确的是( )
| A. | CO燃烧的热化学方程式为:2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| B. | H2燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol | |
| C. | 燃烧前混合气体中H2的体积分数为40% | |
| D. | 燃烧后的产物全部与足量的过氧化钠作用可产生1.25mol氧气 |
20.下列有关气态氢化物某些性质的归纳正确的是( )
①H2S、H2Se在水中的溶解度较小,CH4、SiH4、C2H2不溶于水;
②HF最稳定、SiH4较稳定;
③NH3、H2Se、H2To能在纯氧中燃烧,常温下SiH4能自燃;
④H2S、HI还原性娇弱,NH3、HBr还原性较强;
⑤H2S、HF溶液的导电性较弱.
①H2S、H2Se在水中的溶解度较小,CH4、SiH4、C2H2不溶于水;
②HF最稳定、SiH4较稳定;
③NH3、H2Se、H2To能在纯氧中燃烧,常温下SiH4能自燃;
④H2S、HI还原性娇弱,NH3、HBr还原性较强;
⑤H2S、HF溶液的导电性较弱.
| A. | ①③ | B. | ③④ | C. | ②④⑤ | D. | ①③⑤ |
12.室温下,甲、乙两烧杯均盛有5mL pH=3的某一元酸溶液,向乙烧杯中加水稀释至pH=4.关于甲、乙烧杯中溶液的描述正确的是( )
| A. | 溶液的体积10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)甲≤c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≤乙 | |
| D. | 若分别与5 mL pH=11的NaOH溶液反应,所得溶液的pH:乙≤甲 |
13.下列各组物质中,分子数一定相同的是( )
| A. | 2L CO和2L CO2 | B. | 1mol O2和标况下22.4L H2O | ||
| C. | 0.2mol H2O和4.48L HCl气体 | D. | 9g H2O和0.5mol CO2 |