题目内容
反应2SO2(g)+O2(g) 2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
 2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。
2SO3(g),在一定条件下达到平衡,SO2的起始浓度为8mol/L,O2的起始浓度为2mol/L,SO2的平衡转化率为25%,求平衡时反应混合物中SO3的体积分数。若将O2的起始浓度加大至4mol/L,SO2的起始浓度不变,平衡时测得SO3的浓度为2.8mol/L,求SO2、O2各自的转化率。⑴SO3的体积分数为:22.2%;⑵SO2、O2的转化率均为35%。
⑴设O2的消耗浓度为x,则:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
初始浓度/mol/L: 8 2 0
转化浓度/mol/L: 2x x 2x
平衡浓度/mol/L: 8—2x 2—x 2x
依题意,可得:
K=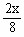 ×100%=25% 解得:x=1 mol·L-1
×100%=25% 解得:x=1 mol·L-1
故SO3的体积分数为: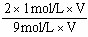 ×100%=22.2%
×100%=22.2%
⑵设O2的消耗浓度为y,则:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
初始浓度/mol/L: 8 4 0
转化浓度/mol/L: 2y y 2y
平衡浓度/mol/L: 8—2y 4—y 2y
依题意,可得:2y = 2.8mol/L
解得:y=1.4 mol/L
所以,SO2的转化率为: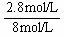 ×100%=35%
×100%=35%
O2的转化率为: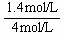 ×100%=35%
×100%=35%
2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)初始浓度/mol/L: 8 2 0
转化浓度/mol/L: 2x x 2x
平衡浓度/mol/L: 8—2x 2—x 2x
依题意,可得:
K=
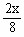 ×100%=25% 解得:x=1 mol·L-1
×100%=25% 解得:x=1 mol·L-1故SO3的体积分数为:
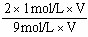 ×100%=22.2%
×100%=22.2%⑵设O2的消耗浓度为y,则:
2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)初始浓度/mol/L: 8 4 0
转化浓度/mol/L: 2y y 2y
平衡浓度/mol/L: 8—2y 4—y 2y
依题意,可得:2y = 2.8mol/L
解得:y=1.4 mol/L
所以,SO2的转化率为:
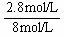 ×100%=35%
×100%=35%O2的转化率为:
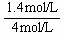 ×100%=35%
×100%=35%
练习册系列答案
 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
 bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是
bY(g)+cZ(g),达到平衡后,保持温度不变,将容器的容积压缩到原来容积的一半,当达到新平衡时,物质Y和Z的浓度均是原来的1.8倍。则下列叙述正确的是 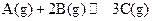 的下列叙述中,能说明反应已达到平衡的是( )
的下列叙述中,能说明反应已达到平衡的是( )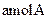 和同时生成3amolC
和同时生成3amolC bR(g)达到平衡后,温度和压强对该反应的影响如下图所示,图中压强p1> p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( )
bR(g)达到平衡后,温度和压强对该反应的影响如下图所示,图中压强p1> p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断( ) 
 2NH3,并达到平衡,此时N2的转化率为c%,向平衡混合物中再次充入N2,重新达到平衡后N2转化率将( )
2NH3,并达到平衡,此时N2的转化率为c%,向平衡混合物中再次充入N2,重新达到平衡后N2转化率将( ) N2+CO2。有关该反应的下列叙述正确的是( )
N2+CO2。有关该反应的下列叙述正确的是( )  2C(g)+3D(g)的反应,其中A、B、C、D的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1、0.3 mol·L-1,当反应达到平衡时,各物质的物质的量浓度不可能是( )
2C(g)+3D(g)的反应,其中A、B、C、D的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1、0.3 mol·L-1,当反应达到平衡时,各物质的物质的量浓度不可能是( )